Искусственный интеллект на ранних этапах разработки лекарственных препаратов
Фарминдустрия достаточно консервативна, поэтому довольно сложно идет на какие-то серьезные изменения. Для того чтобы, например, разработать успешные лекарства, у компании уходит до 3 миллиардов долларов США, а разработка может занимать до 14 лет. При этом далеко не все препараты успешно выходят на рынок.

Консервативность лекарственной отрасли частично объясняется тем, что в ней довольно строгие правила проведения исследований, повышенные требования к эффективности и безопасности молекул, имеется много жестких регуляторных ограничений. Всё это или тормозит, или накладывает ограничения на развитие цифровизации в индустрии.
Однако сегодняшние темпы и масштабы медицинских и научных инноваций, а также растущие объемы информации все-таки трансформируют эту индустрию, и она вынуждена подстраиваться под новые технологии в науке, медицине и IT. Цифровизация приходит в фарму в ответ на увеличение объемов данных и их постоянный рост.

Для чего нужен и как используется искусственный интеллект на ранних этапах разработки лекарственных препаратов? — об этом рассказывает главный эксперт-биолог и научный аналитик компании «Semantic Hub» Анна Палеева.
— Какие драйверы стимулируют фарму к цифровизации?
Анна: Эксперты предсказывают, что к 2025 году в мире будет накоплено 175 Зеттабайт данных. Один Зеттабайт – это секстиллион байт, либо 1 миллион миллионов гигабайт. Это какие-то совершенно невероятные числа, которые совершенно невозможно представить в уме. И эти данные могу включать в себя абсолютно все, в том числе и сведения, важные для медицины:
- генетические данные;
- данные ДНК;
- данные с носимых медицинских устройств, которые используют пациенты;
- научная литература и многое другое.
Одновременно увеличиваются вычислительные мощности для анализа такого огромного потока данных. При этом происходит некоторое снижение затрат на вычисления.
Инновации в биомедицине тоже подталкивают фармацевтические компании к развитию.

— Однако обстановка вокруг фарминдустрии все равно довольно сложная?
Анна: С другой стороны, она же и стимулирующая. Если фармкомпании не будут развиваться, цифровизироваться, то, по некоторым оценкам, Deloitte, например, это может привести к снижению прогнозируемой отдачи от инвестиций уже на более поздних стадиях разработки молекул. Поэтому происходит обострение конкуренции между разными компаниями, сокращение времени цикла на исследование и разработку, сокращение времени на рынке из-за истечения сроков действия патентов, снижение пиковых продаж. Немалую роль играет усиление контроля со стороны регулирующих органов.
В итоге сегодня фарминдустрия становится одной их самых динамичных отраслей, что приводит к оптимизации процессов производства лекарственных средств, к эволюции бизнес-моделей и даже к смене различных парадигм.
Одна из новых парадигм – Patient Centricity, то есть ориентация на пациента, предполагает производство лекарств для конкретных пациентов, в том числе в рамках идеи персонализированной медицины. Также меняется взаимодействие с регуляторными органами, с FDA (Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов). Появляются возможности работать с качественными Big Data. Всё это, в итоге, может привести к повышению эффективности производства новых продуктов и снижению затрат.

— Как обычно происходит создание препарата?
Анна: Воронка» создания препарата включает несколько этапов.
На самом раннем этапе поиска молекул у исследователей может быть до десяти тысяч кандидатов, из них на стадии Drug discovery отсеиваются, практически, все. И на стадию доклинических исследований, где молекулы начинают испытываться на in vitro моделях — клеточных культурах или животных — попадает всего около 250 молекул.
На этап клинических испытаний, когда это всё можно пробовать на людях, доходят примерно пять молекул.
Регуляторы, в лучшем случае, одобрят какую-нибудь одну молекулу
Основная задача создания препаратов — сделать их эффективными, безопасными и доступными. За этим следят сами фармкомпании, ученые и регулирующие органы, такие как FDA, и даже пациенты. Это очень долгий процесс, и около 85 % препаратов улетает буквально в помойку, не доходя до стадии выхода на рынок.

— Что ожидают разработчики лекарственных средств от искусственного интеллекта?
Анна: В первую очередь он может помочь сделать весь процесс дешевле, быстрее и эффективнее. Использование искусственного интеллекта может привести к снижению затрат, связанных с поиском и разработкой новых молекул на 70 миллиардов долларов в ближайшие 10 лет, что даст до 40% совокупного среднегодового темпа роста индустрии.
Применение искусственного интеллекта для разработки лекарственных препаратов возможно на всех вышеперечисленных этапах.
На первой стадии, Drug discovery — поиска и разработки ключевой молекулы — основная роль искусственного интеллекта заключается в прогнозировании взаимодействия между молекулами: как будут будущие лекарства взаимодействовать с белками в клетках человека. Также ИИ может использоваться для изучения и понимания механизмов заболевания. Соответственно, в этот период с помощью ИИ происходит поиск новых решений, биомаркеров, выявление и утверждение оптимизации молекул кандидатов, чтобы из 10 000 компаундов можно было быстро и эффективно найти что-то очень полезное.
Искусственный интеллект может участвовать в процессе Drug repurposing, когда уже существующие для определенных заболеваний препараты перепрофилируются для других заболеваний. В перспективе это снизит необходимость проведения испытаний на животных.
ИИ может в будущем привести к существенному сокращению необходимости первой фазы клинических испытаний.

Уже более сорока крупных фармкомпаний активно применяют искусственный интеллект на стадии Drug discovery. Как правило, это коллаборации с небольшими стартапами или с такими глобальными компаниями, как Microsoft, Google, IBM Watson, которые уже предлагают всевозможные разработки с использованием искусственного интеллекта в медицине.
Помимо этих гигантов существуют более 230 AI стартапов, которые применяют искусственный интеллект для нужд фармкомпаний на этапе поиска и разработки (Research and development). Они занимаются перепрофилированием лекарств, изучают взаимодействие между препаратами и их мишенями в клетке, создают огромные базы данных существующей терапии, чтобы фармразработчики могли использовать эту информацию для более быстрого поиска ответов на какие-то вопросы, связанные с исследованиями. Также они берут на себя обработку всевозможных видов так называемых «сырых», т.е. необработанных, данных, которые компании могут использовать для своих нужд в R&D.

— Приведите, пожалуйста, примеры интересных тандемов разработчиков и фармацевтических компаний.
Анна: Следует обратить внимание на компанию Benevolent и ее два продукта: BenevolentBio, BenevolentAI. С ней активно сотрудничают Новартис, АстраЗенека, Янсен. Они разрабатывают систему искусственного интеллекта, который агрегирует информацию из всевозможных биомедицинских баз данных, массивов данных из клинических испытаний в целях подбора терапии на основе уже существующих лекарств для репозиционирования.
Еще одна интересная разработка – игра Foldit. Она была придумана коллективом ученых двух факультетов Вашингтонского университета — Computer Science and Engineering и факультета Biochemistry. Многие из этих разработчиков ранее участвовали в создании другого цифрового продукта — Rosetta. Он известен среди биохимиков как программа, которая занимается подбором третичных структур белка.

Концептуальная схема Foldit — «игра с целью». Согласно парадигме, участники по результату игры помогают в решении проблем, которые не подвластны компьютерам.
Это в каком-то смысле работает, как капча, которую мы видим в Google, когда нас просят выделить светофоры или машинки. Тем самым мы, на самом деле, помогаем Google обучать их нейронные сети по распознаванию образов.
Разработчиками Foldit была сделана ставка на человеческую интуицию. Любой человек, не обязательно с биохимическим образованием, может попробовать поиграть в эту игру, поскручивать белки, как тетрис.
Это не просто подбор всех возможных вариантов, как это бы делала машина, это интеллектуальный мозговой штурм, в результате которого супер-компьютер гораздо быстрее находит параметры для скрутки белка так называемого folding.
Поскольку белки по своему пространственному строению очень сложные, то таких вариантов строения молекулы может быть слишком много. Если размер моделируемого белка большой, то сложность проблемы растёт нелинейно. Поэтому компьютерные алгоритмы здесь могут не справляться, а вот человек с его естественным интеллектом может гораздо быстрее дать правильный ответ. Используя игровую форму, создатели разрабатывают новые алгоритмы поиска, которые можно будет использовать при компьютерном моделировании. Сейчас они сделали новый «пазл», связанный с коронавирусом.
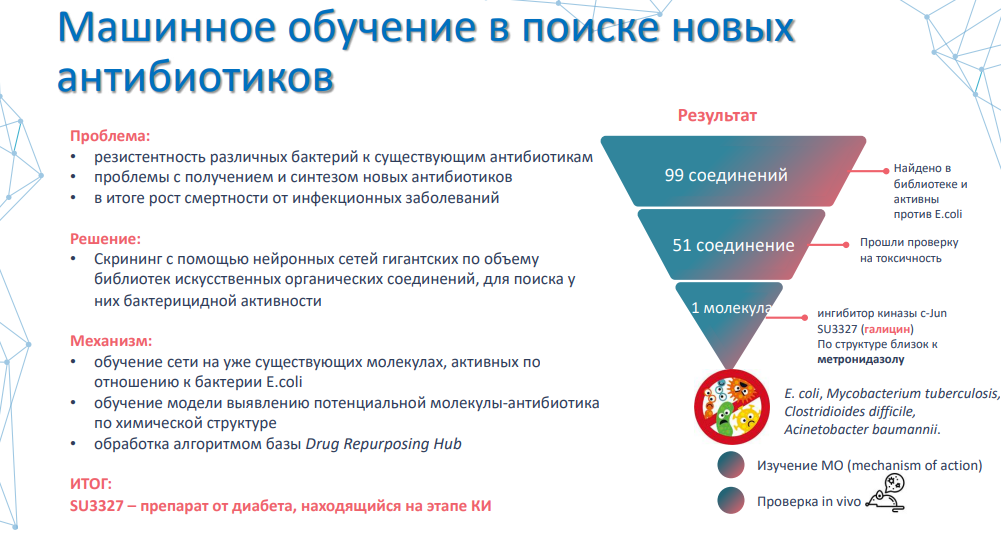
Ещё один замечательный пример — это использование машинного обучения в поиске новых антибиотиков. Результаты этого исследования были напечатаны совсем недавно, в феврале этого года, в журнале Cell.
Одной из глобальных проблем в поисках новых антибиотиков является проблема резистентности бактерий к различным антибиотикам. Более того, с помощью горизонтального переноса генов, бактерии способны очень быстро обмениваться генами резистентности к бактерицидным средствам. Таким образом, они обеспечивают ещё большую защиту от действия существующих антибиотиков.
Большинство антибиотиков, использующихся сейчас для лечения бактериальных инфекций, были обнаружены и получены путем скрининга метаболитов, которые выделяются почвенными микроорганизмами. Часть антибиотиков были получены полусинтетическим методом, посредством навешивания различных химических групп на уже известные антибиотики. Есть небольшое количество антибиотиков, которые были получены полностью синтетически. То есть проблема заключается в том, что при поиске новых антибиотиков выделяются либо похожие антибиотики, которые уже существуют, либо не выделяются вовсе. Синтезировать их, в общем, довольно сложно.
— Почему ситуация с разработкой новых антибиотиков сейчас встала так остро?
Анна: Если текущая ситуация с разработкой новых антибиотиков не поменяется в лучшую сторону, то по пессимистическим прогнозам к 2050 году на долю инфекционных заболеваний может приходиться до 10 миллионов смертей ежегодно. Поэтому коллектив ученых из MIT решил заняться этой проблемой. Они разработали нейронную сеть, которая может скринировать огромные библиотеки уже существующих искусственных органических соединений для поиска у них бактерицидной активности.
Нейронную сеть обучали как на уже существующих молекулах, которые были активны по отношению к известной всем бактерии Escherichia coli, дтак и на моделях выявления потенциальных антибиотиков по химической структуре молекулы. После запуска нейросети на базы Drug Repurposing Hub ими было найдено 99 соединений из этой базы, которые действительно подтвердили свою активность против Escherichia coli, из них 51 соединение прошло проверку на токсичность. Среди этих молекул уже была найдена одна-единственная молекула SU 333 27, ее назвали галицин.
Она по структуре очень близка к ныне существующему антибиотику метронидазолу, а вообще она является ингибитором киназы c-Jun, и она была активна по отношению к большинству самых известных бактерий: Escherichia coli, Mycobacterium tuberculosis, бактерии, вызывающей туберкулёз, бактериям, вызывающим колит (Clostridioides difficile) и другие воспалительные заболевания.
Самое удивительное, что эта молекула – на самом деле препарат, разработанный для лечения людей с диабетом 2 типа, находящийся сейчас на этапе клинических испытаний. То есть, это — пример возможного репозиционирования молекулы на другое показание.
Исследователи изучили механизм действия этой молекулы, также проверили её in vivo на мышах, и она тоже была активна, а зараженные всевозможными бактериями мыши прекрасно выживали при лечении ей. Однако еще предстоит пройти клинические испытания для того, чтобы из найденной молекулы получилось лекарство.
Подход прекрасно демонстрирует всю мощь компьютерного поиска препаратов. Было бы невозможно физически за столь короткое время проверить более 100 м соединений на бактерицидную активность без применения искусственного интеллекта.
Продолжение интервью по ссылке.
Подготовила Надежда Данилова