Цифровая трансформация патологоанатомической службы как путь повышения качества медицинской помощи
Сведения об авторах:
- Лебедев Г.С. – д.т.н., профессор, заведующий кафедрой информационных и интернет-технологий Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовский университет); заведующий отделом инновационного развития и научного проектирования ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» МЗ РФ; Москва, Россия; РИНЦ AuthorID 144872
- Шадеркин И.А. – к.м.н., заведующий лабораторией электронного здравоохранения Института цифровой медицины Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовский университет); Москва, Россия; РИНЦ Author ID 695560
- Тертычный А.С. – д.м.н., профессор кафедры патологической анатомии Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовский университет); Москва, Россия; РИНЦ AuthorID 450280
- Шадеркина А.И. – студентка 3го курса Института клинической медицины Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовского университета); Москва, Россия; РИНЦ AuthorID 1064989
- Анциферова Е.О. – студентка 5-го курса Международной школы «Медицина будущего» Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовского университета); Москва, Россия
- Лебедева Н.А. – студентка 3-го курса Института общественного здоровья имени Эрисмана Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовского университета); Москва, Россия
ВВЕДЕНИЕ
Патоморфология является неотъемлемой и важной частью при постановке диагноза и выборе тактики ведения пациентов не только в онкологии, но и других медицинских сферах.
Основным инициатором (заказчиком) проведения патоморфологического исследования, возможно, за исключением аутопсии (некропсия, посмертное исследование), является врач-клиницист, который не только ставит перед патологоанатомом задачу постановки патоморфологического диагноза, но и активно принимает участие в этом процессе, выполняя биопсию, отправляя орган или его часть на патологоанатомическое исследование после выполненной операции. Несмотря на это, клиницисты и патологоанатомы разъединены между собой: очень редко лично контактируют, редко проводят консилиумы, порой используют разную терминологическую базу. В других же направлениях диагностики клиницист принимает более активное участие, а зачастую даже сам участвует в анализе выполненных диагностических исследований. Ярким примером является активное участие клинициста, хирурга, уролога в изучении рентгенологических снимков при принятии решения о выборе тактики решения, включая хирургию. В ряде ситуаций клиницист и сам является диагностом, например, при выполнении УЗИ, цистоскопии и прочее. В этом плане патологическая анатомия, являясь диагностической дисциплиной, стоит особым образом в ряду используемых клиницистами инструментов. Возможно, сложность выполнения патологоанатомических исследований, специфические инструменты, микроскопы и сложная, порой запутанная, исторически сложившиеся терминологическая база отдаляет от клинициста столь важный диагностический инструмент.
С другой стороны, дефицит кадров и в ряде отдаленных регионов России дефицит оборудования приводит к сложностям в работе патологоанатомической службы [1].
При этом патологоанатомическая специальность развивается, в арсенале появляются новые мощные инструменты, такие как иммуногистохимия (ИГХ), молекулярная диагностика; появляются современные аппаратные решения, призванные автоматизировать процесс, повысить качество патологоанатомической диагностики. Но, как и любые новые технологии, все они влекут за собой экономическое бремя на лечебно-профилактические учреждения (ЛПУ), которые порой сталкиваются с дефицитом ресурсов, что тормозит развитие и внедрение этих технологий в рутинной клинической практике.
Цифровые, информационные, дистанционные технологии, являясь прорывными («disruptive» – разрушительный, подрывной), проходят через все аспекты нашей жизни, включая медицину, и, в частности, патологическую анатомию.
Целью нашей аналитической статьи является рассмотрение возможностей использования цифровых технологий в решении задач патологической анатомии с акцентом на сближение с клиническими дисциплинами. В этой статье мы представляем возможности и перспективы организации бизнес-процессов в этом направлении от постановки задачи для патологоанатома, получения биологического материала, проведения исследования и до совместной аналитики клиницистами полученных результатов для выбора дальнейшей тактики лечения и ведения пациента с учетом возможностей информационных технологий. Стоит отметить, что в задачи статьи не входило рассмотрение возможностей цифровых технологий в посмертном исследовании, акцент сделан на прижизненное исследование. Однако, стоит отметить, что такой подход к анализу материала по нашем мнению не имеет жесткого ограничения и с поправкой на особенности выполнения специфических моментов может также быть использован в других видах обследований.
Для упрощения терминологии в названии статьи и в дальнейшем мы будем использовать такое устоявшееся понятие как «цифровая патоморфология» («digital pathology»), делая поправку на то, что терминологически это определение включает в себя не только этап микроскопического анализа, но и ряда других этапов патологоанатомического исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Поиск информации производился на базе данных Medline и Pubmed по запросам, включающим в себя формулировки «digital pathology» (8387 результатов), «telepathology» (205 результатов), а также термины, соответствующие тематике каждого из абзацев раздела «Результаты»:
- выставление показаний к проведению патоморфологического исследования – electronic «medical record system» (14206 результатов), «pathologists and clinicians communication» (250 результатов);
- забор биоматериала – «teleoperating room» (29 результатов), «tele-proctoring» (6 результатов), «fusion biopsy» (14103 результата), «biopsy mapping» (10148 результатов), «template prostate biopsy» (259 результатов);
- подготовка биоматериала – «tissue fixation standardization» (216 результатов), «barcode labeling» (1076 результатов);
- транспортировка – «optimization of transport of biomaterials» (228 результатов);
- макроскопия – «grossing pathology» (98 результатов), «macroscopic examination» (1677 результатов);
- пробоподготовка – «slide-free pathology» (3 результата);
- полноформатное сканирование стекол (WSI) – «DICOM microscopy» (9 результатов);
- анализ данных – «digital pathology multidisciplinary» (55 результатов);
- использование интеллектуальных инструментов для анализа оцифрованных данных – «machine learning prostate cancer pathology» (5 лет – 283);
- статистический анализ – «computational pathology» (73882 результата);
- участие пациента – «treatment adherence emr» (5 лет – 114), «patient-friendly pathology» (51 результат).
Кроме того, поиск осуществлялся на сайтах разработчиков устройств, применяемых в цифровой патоморфологии, а также на сайтах журналов, специализирующихся на данной теме, таких как Journal of Pathology Informatics [2].
РЕЗУЛЬТАТЫ
При анализе актуальность темы была подтверждена широким использованием термина «digital pathology» как в статьях, так и на сайтах профессиональных ассоциаций. Этот термин подчеркивает высокую заинтересованность профессионального сообщества, поскольку развитие данной сферы патологической анатомии приводит к появлению собственной терминологии. Первые статьи об использовании телемедицинских технологий в патологоанатомическом исследовании отмечаются с 1986 года [3]. Несомненно, в основе цифровой патоморфологии лежит полноформатное сканирование. Интерес к данной области подтверждается обсуждениями развития и регулирования цифровой патоморфологии на форумах и конференциях патологоанатомов [4, 5]. За последние 5 лет количество публикаций в Pubmed по запросу «digital pathology» увеличилось со 135 до 465 статей в год.
Однако неправильно использовать только полноформатное сканирование стекол (whole slide imaging, WSI) поскольку возможности цифровой патологии гораздо шире. В данной статье рассмотрены технологии и решения, которые могут быть применены для стандартизации подходов к работе с биоматериалами и создания единой цифровой патологоанатомической системы, тесно связанной с общеклинической информационной системой.
Из-за того, что тема очень большая, в статье для удобства изложения мы разбили найденную информацию на блоки, которые соответствуют основным этапам проведения патоморфологического исследования: от этапа постановки показаний для выполнения исследования, до этапа анализ информации специалистами и потенциального участия в этом процессе самого пациента.
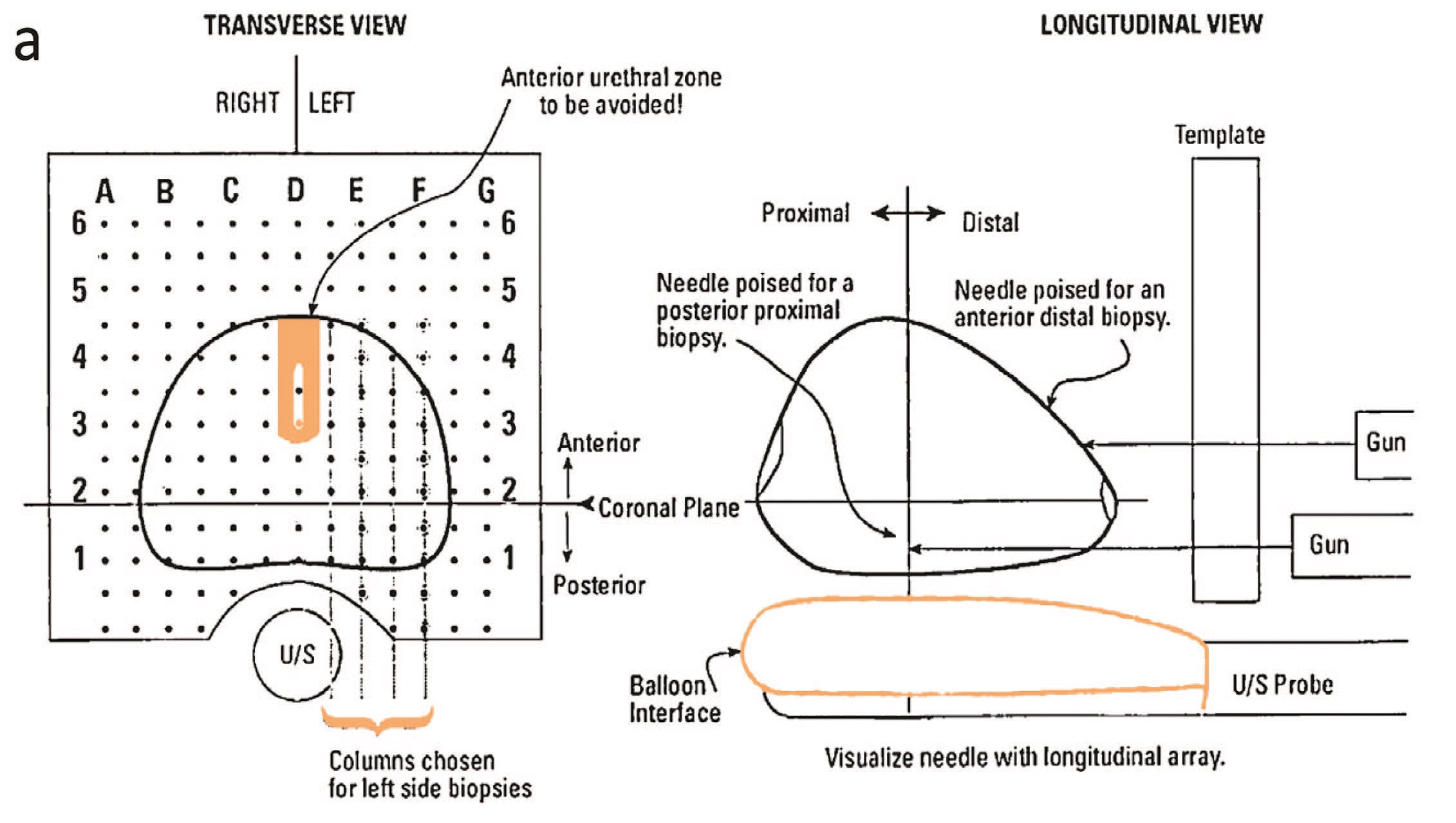
Рис.1a. Источник: Singh P.B. и соавт. Особенности опухоли рака предстательной железы на шаблонных биопсиях предстательной железы: значение для фокальной терапии [36]
Fig.1a. Source: Singh P.B. et al. Prostate Cancer Tumor Features on Template Prostate-mapping Biopsies: Implications for Focal Therapy [36]
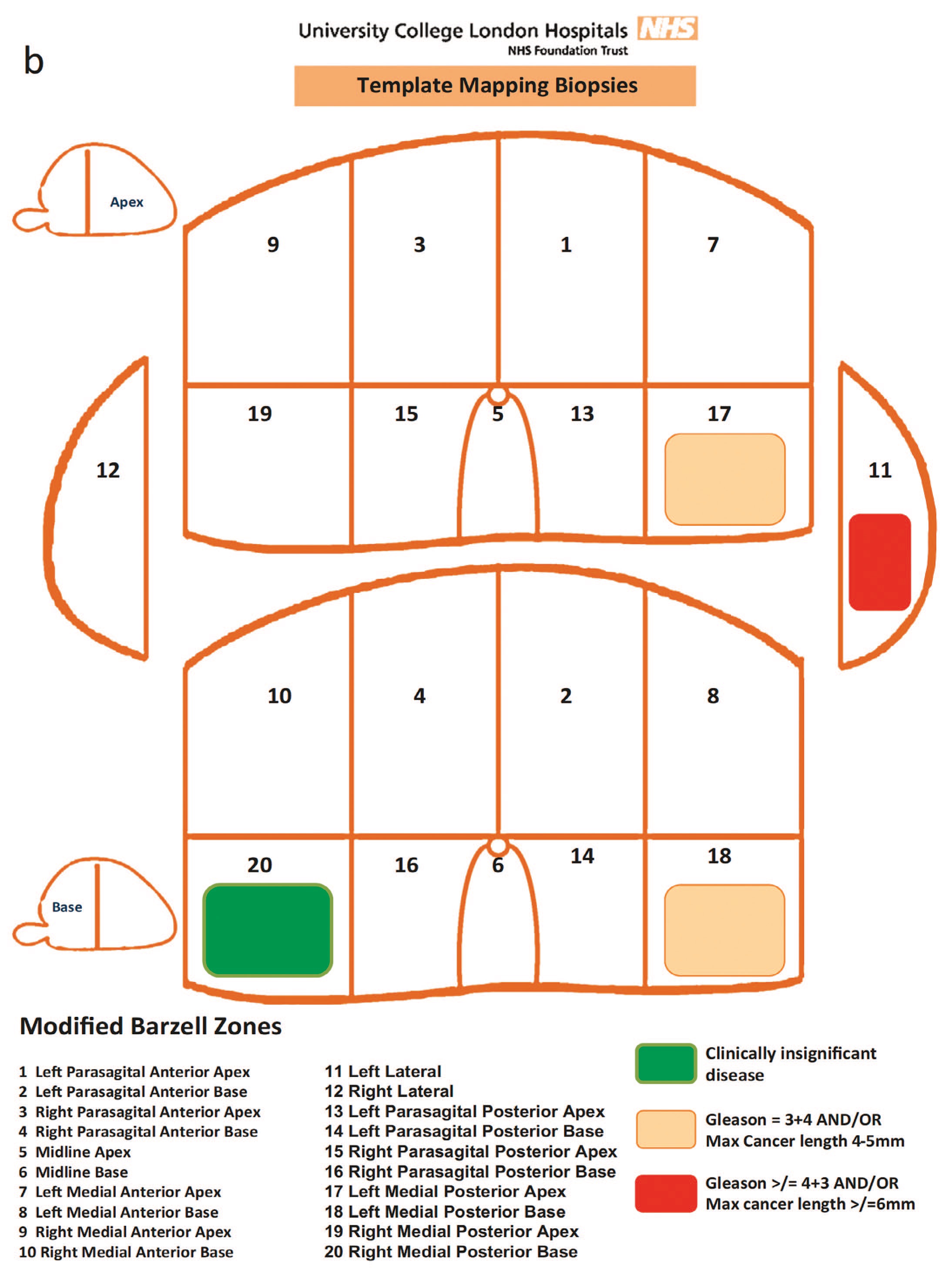
Рис.1b. Источник: Singh P.B.и соавт. Особенности опухоли рака предстательной железы на шаблонных биопсиях предстательной железы: значение для фокальной терапии [36]
Fig.1b. Source: Singh P.B. et al. Prostate Cancer Tumor Features on Template Prostate-mapping Biopsies: Implications for Focal Therapy [36]
Выставление показаний для патоморфологического исследования
Выставление показаний к проведению диагностической биопсии является первым этапом длинного пути, завершающегося патоморфологическим заключением. И этот этап инициализирует врач-клиницист, в подавляющем большинстве без участия врача патологоанатома.
Всемирная ассамблея здравоохранения, состоявшаяся 23 мая 2005 года в Женеве, приняла резолюцию по электронному здравоохранению (WHA 2005), призывающую страны разработать планы развития электронного здравоохранения и сосредоточиться на их реализации [6]. Одним из понятий, относящихся к электронному здравоохранению, являются единые медицинские электронные системы. Создание таких систем позволяет организовать все имеющиеся ресурсы здравоохранения наиболее выгодным способом, а главное создать непрерывность медицинской помощи. Отсутствие координации между различными больницами и специалистами приводит к дублированию выполняемых исследований, увеличивает количество посещений врача, а значит и нагрузку на систему здравоохранения. На данный момент уже можно найти примеры и результаты внедрения электронного здравоохранения в различных странах [7, 8, 9]. Например, в Тайване, где насчитывается около 500 госпиталей и 20 000 клиник, было отмечено, что на 1 пациента приходится до 15 консультаций врача в год, а лабораторные исследований и назначения дублируют друг друга, что приводит к чрезмерной работе здравоохранения [10]. Правительством был принят «План по ускорению внедрения электронных систем медицинской документации в медицинских учреждениях», вступивший в силу с 2010 года.
Такая система позволит врачу получить доступ к записям о пациенте, результатам проведенных исследований из любой другой больницы, настроить коммуникацию между специалистами. Это важно, так как лечение пациента часто требует сотрудничества специалистов разных областей и обмена знаниями между ними.
Сотрудничество между специалистами можно достичь, используя электронные системы. В одном исследовании авторы опросили специалистов 5 клиник, чтобы выявить преимущества и недостатки при коммуникации через единую систему больниц [11]. Несмотря на ряд выявленных ограничений, связанных в том числе с техническими проблемами, авторы отмечают, что электронные медицинские карты облегчают сотрудничество между специалистами. Взаимный доступ к данным пациентов независимо от места и времени приводит к созданию наиболее полной медицинской карты и облегчению принятия совместного клинического решения. Появляется возможность ознакомиться с логикой принятия решений другого специалиста, просмотреть результаты лабораторных и функциональных исследований.
Кроме того, распространение электронных медицинских карт и внедрение единых электронных медицинских систем делают возможным внедрение различных клинических рекомендаций, медицинских калькуляторов и стандартов прямо в систему. Это является шагом на пути к системам поддержки принятия решений для врачей. А значит улучшению процента пациентов, получающих необходимое лечение [12, 13].
Для правильной постановки диагноза и назначения необходимого лечения требуется скоординированная работа лечащего врача и врачапатологоанатома. Однако их взаимодействие может быть ограничено как различиями в терминологии, классификациях, устоявшихся только среди патологоанатомов формулировках, используемых при написании заключения, так и отсутствии доступа патологоанатома к истории болезни и иной медицинской документации пациента [14]. Исследование Barbieri A.L. показало, что наличие внутренней почтовой системы не всегда обеспечивает быстрое взаимодействие между клиницистами и патологоанатомами вследствие низкой заинтересованности патологоанатомов в использовании специализированных мессенджеров. Только 29% из участвовавших в исследовании специалистов использовали данную систему и только 18% проверяли почту каждый день во время работы [15]. Кроме того, в мультицентровом исследовании Gibson B.A. была оценена разница в понимании формулировок в патологоанатомических заключениях среди патологоанатомов, клиницистов и резидентов. Так, фразы «подозрение на» и «совместимость с» получили наименьшее согласие между специалистами в их значении, в том числе среди патологоанатомов. Только 52% из опрошенных практикующих врачейклиницистов и 8% из резидентов-клиницистов оценили чтение патологоанатомических заключений как очень комфортное. Возможным решением проблемы взаимопонимания авторы считают создание стандартов по формированию патолого-анатомических заключений [16]. Исследовательская группа Корейского общества патологоанатомов разработала формат стандартизированного патологоанатомического заключения для рака молочных желез, состоящий из обязательных (стандартных) данных и заполняемых в зависимости от дополнительных условий, а также формы для биомаркеров [17]. Наличие доступа у врача-патологоанатома к истории болезни пациента может быть необходимо для решения о проведении дополнительных исследований тканей, использования специальных методов окраски [18]. В настоящее время разрабатываются и внедряются в медицинских учреждениях программные обеспечения, обеспечивающие патологоанатомам прямой доступ к клинической и радиологической информации [19].
Забор биоматериала
Операционная – это единый живой организм, элементы которого связаны между собой для достижения наиболее значимых результатов. Одной из частей является и система видеофиксации происходящего в пределах операционной, включая эндоскопическую регистрацию хирургических манипуляций. Первым аналогом современных телемедицинских коммуникаций в хирургии стала видеоконференция с операцией по замене аортального клапана в 1962 году [20]. Современные информационные технологии позволяют полностью фиксировать этапы хирургических вмешательств, сохранять эти данные, передавать и просматривать их как в прямом времени, так и в любое время после операции. Преимуществом такой системы является внесение видеоматериалов в электронные истории болезни. Благодаря этому лечащие врачи могут обращаться к данным материалам по необходимости и вносить корректировки в процесс лечения. Видеофиксация процесса эндоскопии и, в частности, забора биопсии, могла бы облегчить задачу патологоанатомам. Возможность увидеть, как и из какой точки был взят биоматериал, в перспективе облегчает процесс постановки диагноза или его корректировки.
Инструменты для видеосъемки хирургических операций в настоящее время уже внедряются в практику. В частности, их применяют для дистанционного контроля за операционным процессом, а также для дальнейшего пересмотра, когда возникают необходимость в уточнении этапов проведения операции. Так Artsen и соавт. разработали систему для удаленного наблюдения, которая включает камеру в операционной, которая может перемещаться и демонстрировать общий вид операционного стола. Другая камера с робота, при помощи которого выполняется операция, дает возможность получить полное изображение операционного поля. Таким образом, опытный хирург может наблюдать за действиями обучающегося и контролировать процесс за счет двусторонней аудио- и видеосвязи [21].
Видеофиксация активно применяется в составе интегрированных операционных. Так, система OR1™ включает рабочую станцию, позволяющую осуществлять захват, архивирование и редактирование фото- и видеоматериалов. Кроме того, имеется возможность интегрировать полученные данные в электронные истории болезни, благодаря чему лечащие врачи могут иметь доступ к материалам из операционной [22].
Существуют и входят в практику решения для видеосъемок процесса эндоскопии. Одним из них является система VISERA ELITE II, созданная компанией OLYMPUS. Данный аппарат совместим со многими видами эндоскопов и может использоваться в различных методах обследования, что дает возможность использовать его во множестве направлений медицины. Также, благодаря этим преимуществам, возможно фиксировать процесс забора биоптата [23]. Все описанные решения могут быть использованы и при проведении диагностических биопсий с получением доступа врача-патологоанатома к снятым в ходе вмешательства материалам. Все более активное использование интегрированных операционных приводит к внедрению искусственного интеллекта, который самостоятельно распознает этапы операции, инструменты, используемые в ходе манипуляций, а так же анатомические структуры, которые подвергаются хирургическому вмешательству, либо являются патологическими и требуют более тщательного осмотра со стороны оперирующего хирурга [24, 25].
Для создания единой системы взаимодействия хирурга и патологоанатома возможно использование не только фото- и видеофиксации забора биоматериала, но и использование дополнительных источников визуализации, таких как УЗИ, МРТ или рентген. В исследовании рака простаты и проведении ее биопсии в настоящее время применяется так называемая «фьюжн биопсия» (fusion biopsy, где fusion – «сплавление»), в которой забор материала осуществляется под контролем МРТ и трансректального УЗИ (ТРУЗИ) [26]. МРТ исследование позволяет выделить участки интереса, данные о которых передаются в систему фьюжн биопсии. Выбранные участки в режиме настоящего времени идентифицируются с помощью ТРУЗИ при проведении биопсии. Необходимо отметить, что идентификация участков интереса осуществляется с помощью наложения на изображения, получаемые на ТРУЗИ, МРТ-изображений. Кроме того, система позволяет сохранить информацию о топографии взятого материала, который могут быть показаны в программе на 3D-изображении предстательной железы (ПЖ). В биопсии тканей поджелудочной железы так же возможно применение эндоскопического УЗИ для более точной локализации областей интереса в диагностике аутоиммунного панкреатита [27]. Под ультразвуковым контролем проводится так же и сердцевинная игольная биопсия тканей щитовидной и паращитовидных желез [28].
Проспективное рандомизированное одноцентровое исследование показало высокую эффективность проведения УЗИ-ассистируемых хирургических вмешательств при резекции протоковых инвазивных опухолей молочных желез [29]. 93% пациентам не потребовалось проведение повторной операции против 65% пациентов, у которых контроль операции проводился с помощью метки. Применение ультразвука в ходе оперативных вмешательств позволяет более точно определять области интереса, является экономически доступным методом и предотвращает избыточное иссечение здоровых тканей [30, 31].
Наличие определенных протоколов, по которым выполняется биопсия, позволяет стандартизировать и оптимизировать работу с тканями, в том числе снижая вероятность проведения повторных вмешательств. Так, например, внедрение протокола биопсии пищевода для пациентов с дисфагией увеличило выявление эозинофильного эзофагита в 50 раз [32]. Данный способ взятия биопсии предполагал взятие по 4 биопсии на 4 и 14 см выше пищеводно-желудочного перехода у всех пациентов.
Кроме того, по протоколу необходимо было проведение подсчета эозинофилов, и наличие более 15 эозинофилов в одном поле зрения расценивалось как случай эозинофильного эзофагита. Определение точной локализации патологических зон позволяет производить картирование органов – создание биопсийной карты, которая позволяет привязать материал к определенной анатомической зоне [33, 34]. Кроме того, в настоящее время применяется шаблонная (темплит) биопсия ПЖ. На этапе забора следую согласованному протоколу выполнения процедуры хирург забирает биопсийный материал из определенной анатомической области и нумерует его согласно анатомической карте органа. Исследование Bittner и соавт. показало большую выявляемость рака простаты с использованием шаблонной биопсии, чем с помощью ТРУЗ биопсии. Шаблонная биопсия позволила выявить рак ПЖ у 679 из 1118 пациентов с негативными результатами ТРУЗ биопсии [35].
Подготовка биоматериала к транспортировке и последующим этапам патоморфологического исследования
Одним из ключевых этапов работы с биоматериалом для патологоанатомического исследования является его фиксация в формалине, либо изготовление замороженных блоков, в зависимости от вида проводимого исследования. От качества выполнения данного этапа зависит дальнейшая работа с препаратом, однако он не зависит на сегодняшнем этапе от патологоанатома. Это все лежит на плечах хирургической бригады, которая выполняет забор биоматериалы. Длительная фиксация материала, несоблюдение температурного режима и использование различных фиксаторов в лабораториях приводят к снижению качества дальнейшей подготовки препаратов, нарушению биохимических и структурных свойств тканей, что является критичным при микроскопическом анализе. В статье Bauer R. D. и соавт. предлагается создание и использование стандартизированных подходов к выполнение данного этапа [37]. Фиксация материала осуществляется 2+2 протоколом, который предполагает 2 часа нахождения образцов в 10%-ном нейтральном буферном растворе формалина, охлажденном до 4 °C, а затем – 2 часа в таком же растворе с температурой 45 °C. Такая методика позволяет сократить время подготовки препарат с 24 часов до 4 часов, а также избежать холодовой ишемии тканей при дальнейшей транспортировке.
Обеспечить целостность образцов позволяет так же и использование кассет, в которые складываются вырезанные полученные биопсийные материалы. При этом существуют различные по размеру кассеты, поскольку возможные размеры образцов могут значительно отличаться [38, 39].
Исследование Sunny N. и соавт. также показало значимость стандартизированной и качественной подготовки биопсийных образцов [40]. В данном статье авторы использовали два подхода для работы с сердцевинной игольной биопсией (core needle biopsy): в первом случае хранение полученных биопсийных образцов осуществлялось в 10%-ном буферном растворе формалина, где ткани свободно лежали («плавали»), а далее переносились в чашку Петри и производилась дальнейшая пробоподготовка. Во втором случае биопсийные образцы помещались между двумя квадратами полиуретановой пены размерами 2x3 см и толщиной 0,3 см, и вся конструкция опускалась в кассету для хранения блоков. Далее кассеты запечатывали и опускали в 10%-ный буферный раствор формалина, в котором и производилась дальнейшая транспортировка образцов. Результаты исследования показали, что рутинный способ подготовки, то есть, с использованием взвешенного в формалине хранения тканей, приводит к потере первоначальной формы, что затрудняет дальнейшую микротомную нарезку и приводит к значительной деформации структур тканей на микроскопическом уровне. Микроскопия препаратов, полученных с помощью второго способа, показала отсутствие повреждения тканей.
С этапа подготовки полученных в ходе биопсии тканей появляется возможность присвоения штрихкода каждой кассете или иному месту хранения материала. Штрихкод необходим для идентификации кассет, стекол с препаратами и их объединения с иными метаданными о пациенте [41]. Mandecki W и. соавт. предложили использование p-Чипа (p-Chip), представляющего собой монолитную интегрированную схему, которая способна отправлять свой идентификационный код с помощью радиочастот [42]. Данный чип может быть прикреплен на кассету или стекло с препаратом. Считывание производится специальным устройством, а результаты отображаются в программе, совместимой с программным обеспечением Windows. Преимуществом данного чипа являются небольшие размеры (600x600x100 нм), а также устойчивость к различным химическим веществам и температурам, применяемым для изготовления микропрепаратов.
Таким образом, этап подготовки тканей и качество его выполнения оказывают значительное влияние на получаемый в дальнейшем патологоанатомический микропрепарат. Создание протоколов работы с материалами на первых этапах ведет к стандартизации подходов и улучшению диагностики.
Транспортировка биоматериала
Процесс транспортировки биоматериалов можно подразделить на его перемещения между помещениями и перевоз на длительные расстояния. В первом случае при переносе образцов ошибки, связанные с неверно переданной информацией, могут привести к постановке неправильного диагноза. Транспортировка биоматериалов на дальние расстояния, усложняет процесс возможной деформацией материалов. Биологические образцы могут испортиться, что делает невозможным их дальнейший анализ. Наиболее эффективным и логичным решением данной проблемы может стать сокращение плеча транспортировки, либо полный отказ от перевозки материалов. Возможность изучать не сам препарат, а его цифровую копию, позволяет устранить ошибки, связанные со сложностью перевозки материалов и их деформацией [43].
Рационализация передачи информации о биоматериале также могла бы эффективно снизить вероятность таких ошибок. Brennan и соавт. разработали чек-лист, заполняемый при передаче образца из операционной в лабораторию, что помогло значительно сократить число ошибок, связанных с неправильной маркировкой или человеческим фактором. Кроме того, авторы обращают внимание на улучшение взаимодействия между хирургами и патологами благодаря данному нововведению [44].
Транспортировка биообразцов на дальние расстояния представляет собой сложный процесс, требующий соблюдения особых условий хранения материала: многослойная герметичная упаковка, маркировка, поддержание температурного режима [45]. Наиболее распространенный способ хранения биоматериалов при транспортировке – криоконсервация, использование низких температур для сохранения биологической ценности образцов. Однако этот способ неудобен ввиду необходимости дополнительного оборудования для поддержания необходимых температурных условий. Активно предлагаются альтернативные решения. Dewhurst и соавт. рассматривают различные использующиеся способы сохранения биоматериалов при транспортировке и выделяют использование гидрогеля как альтернативу криоконсервации [46]. Этот способ высокоэффективен и не требует поддержания определенного температурного режима. Другой способ предлагают Merivaara и соавт. В своей работе они описывают применение лиофилизации для хранения биоматериалов при комнатной температуре, что также упростит процесс их транспортировки [47].
Макроскопия, нарезка биоматериала
Важным этапом патологоанатомического исследования является макроскопическое исследование материала, заключающееся в оценке тканей, органов без использования микроскопа и необходимое для выбора участков интереса и их последующей вырезки. Данный этап определяет весь последующий вектор работы с материалом, и возможные ошибки на данном этапе, такие как, например, не определение саркоматоидных изменений в тканях и выбор патологически не значимых участков для дальнейшего создания микропрепарата, сложны к выявлению. На этой части патологоанатомического исследования возможно получить и важную прогностическую информацию, такую как размеры опухоли, которую так же необходимо зафиксировать и связать с остальной информации об исследуемой ткани. Микроскопические образцы позволяют проанализировать менее 0,2% от всей ткани, что требует тщательного подбора репрезентативных участков вырезки. [48]. Таким образом, значимость макроскопического исследования определяет необходимость в его фото- и видеофиксации [49]. В настоящее время в медицинских учреждениях создаются архивы макроскопических изображений, которые позволяют патологоанатомам фотографировать исследуемый материал и загружать в базу данных, привязывая с помощью штрих-кода к конкретной аутопсии. Данная система позволяет сохранять макроснимки и работать с ними в любое время при наличии доступа к профилю. Таким образом, осуществляется полный цикл анализа, съемки, сохранения, связывания с предыдущими данными по исследованию и последующей дистанционной работы на этапе макроскопического исследования. Авторы так же предполагают дальнейшую интеграцию своей разработки с другими системами работы с патологоанатомическими данными [50].
Необходимо так же отметить различия в подходах к исследованию аутопсийных и биопсийных материалов. Патологоанатомическое исследование аутопсийных образцов включает в себя полное макроскопическое исследование органов, тогда как биопсийные образцы чаще всего являются небольшими частями органов, кроме случаев тотальной вырезки, например, предстательной железы. К гистологическому прижизненному материалу относятся: эндоскопические биопсии, пункционные толстоигольные биопсии, аспирационные биопсии, трепанобиопсии, инцизионные биопсии, операционные биопсии, операционный материал, соскобы, самопроизвольно отделившиеся фрагменты тканей, ткани, полученные при родах и абортах. Различие в изначальном объеме изучаемого материала требует неодинаковых подходов к их дальнейшей подготовке для микроскопического исследования. Исследование аутопсийных образцов обычно не требует значительных временных затрат на транспортировку, поскольку все исследование проводится в патологоанатомическом отделении, тогда как получение биопсийных фрагментов тканей и иного операционного материала и его последующий анализ выполняются в разных местах (операционная и патологоанатомическое бюро) [51].
На этом этапе вырезанные блоки заключаются в кассеты для последующих этапов и маркируются. Этап маркировки может быть автоматизирован с использованием системы присвоения штрих-кодов с внесением данных в электронную информационную систему [52].
ПРОБОПОДГОТОВКА
Процесс пробоподготовки начинается после взятия тканей и выполняется в патологоанатомической лаборатории. Он включает в себя:
- окончательную фиксацию;
- проводку (обезвоживание и пропитывание парафином);
- заливку в парафин с изготовлением парафиновых блоков;
- микротомию (изготовление парафиновых срезов, монтирование их на предметные стекла и высушивание);
- окраску, заключение и высушивание микропрепаратов;
- сортировку микропрепаратов [53].
В настоящее время широко представлены аппараты, способные без участия лаборанта проводить все необходимые этапы пробоподготовки с получением готового микропрепарата на выходе. Проводка и заливка парафином так же осуществляется с помощью устройств-процессоров, вместительность которых достигает 600 кассет одномоментно, что значительно оптимизирует работу с материалом [54, 55]. Такие значительные по вместительности процессоры могут быть использованы в крупных лабораториях с большим потоком требующих подготовки значительного количества патологоанатомических препаратов. Другой трудоемкой частью процесса пробоподготовки является микротомная нарезка тканей. От качества выполнения данного этапа напрямую зависит дальнейшая работа с микропрепаратом, включая его анализ и постановку диагноза. Автоматизированный микротом позволяет ускорить процесс подготовки микропрепарата, предполагает более экономную работу с парафиновыми блоками и стандартизацию данного этапа пробоподготовки [56]. Стандартизация окраски препаратов возможна благодаря использованию устройств, запрограммированных на выполнение стандартизированных протоколов окраски, что повышает качество и снижает количество возможных ошибок, возникающих, например, при избыточной выдержке стекла в одном из красителей. Примерами таких устройств являются Histo-Tek® SL Slide Stainer и Tissue-Tek Prisma® Plus Automated Slide Stainer [57, 58]. Наиболее востребованными являются окраска гематоксилин-эозин и иммуногистохимия, для которой вместо красителей используют антитела, для которых так же существуют автоматизированные устройства для окраски микропрепаратов [59, 60]. Однако использование в лабораториях микроскоповсканеров требует не только автоматизации окраски, но и создание наиболее стандартизированных патологоанатомических стекол, что достигается путем автоматического покрытия микропрепарата специальными пленками или стеклами, что позволяет избежать наиболее часто встречаемых ошибок в ручной подготовке микропрепарата, таких как затеки клея, препятствующие дальнейшей качественной оцифровке [58, 61]. В настоящее время имеются автоматизированные процессоры тканей (automated tissue proccessor), которые осуществляют подготовку микропрепаратов, проводя фиксацию, проводку и пропитывание парафином, с минимальным участием лаборантов [55, 62]. Автоматизирован так же и процесс изготовления замороженных срезов. Для этого существуют специальные криостаты, с помощью которых осуществляется заморозка и нарезка материала, а также стейнеры, производящие окраску замороженных срезов [63, 64]. Описанные устройства пробоподготовки поддерживают идентификацию материалов с помощью штрихкодов, что позволяет связать данный этап работы с патологоанатомическим материалов с остальными частями исследования. Существуют специальные принтеры для печати штрихкодов и их прикрепления к кассетам и стеклам [65-67].
Таким образом, существующие в настоящее время решения позволяют создать полностью цифровую патологоанатомическую лабораторию.
Параллельно развитию сферы автоматизации лабораторной подготовки патологоанатомических препаратов наблюдается появление новых методов патологоанатомической диагностики, которые ведут к отказу в использовании гистологических стекол, так называемые slide-free методы микроскопии [68]. Данный подход позволяет значительно снизить время работы с материалом, поскольку из многоступенчатой подготовки исключается фиксация или заморозка препарата, а окраска микропрепарата становится опциональной, так как самой важной частью становится качественная визуализация структур с помощью высокоразрешающих камер. Кроме того, получает распространение метод «неразрушающей 3D патоморфологии» [69]. В данном варианте работы с тканями не требуется микротомная нарезка и дальнейшая работа со стеклом, окрашивание производится цельный биопсийной ткани флюоресцентными веществами. Преимуществом является отсутствие повреждения микроструктур ткани и клеток благодаря отсутствию этапа нарезки, а информативность метода обеспечивается высокоразрешающими камерами. Данный методы имеют потенциал использования в цифровой патоморфологии, поскольку работа с полученными данными подразумевает полную цифровизацию этапа их анализа.
Полноформатное сканирование патоморфологических стекол
Данный раздел наиболее полно раскрыт в предыдущей нашей статье [70]. Метод Полноформатного сканирования стекол или whole slide imaging (WSI) является основой цифровизации патологической анатомии. В настоящее время для микроскопического этапа работы с патологоанатомическими данными создано наибольшее количество инструментов, таких как микроскопы-сканеры, базы данных, программы для работы с отсканированными изображениями, инструменты для анализа данных как самими врачами-патологоанатомами, так и с использованием искусственного интеллекта. WSI является наиболее актуальной и широко применяемой частью цифровой патоморфологии. Автоматизированные микроскопы позволяют качественно осуществлять сканирование препаратов на нескольких увеличениях, а также применять несколько видов микроскопии (световая, иммунофлюоресцентная и т.д.) в зависимости от вида используемого микроскопа. Кроме того, существуют решения, позволяющие сканировать сразу до 400 микропрепаратов, что значительно ускоряет работу и уменьшает нагрузку на врачапатологоанатома [71, 72]. Некоторые из микроскопов имеют регистрационное удостоверение и применяются в рутинной клинической практике отдельных медицинских центров. Однако существуют ограничения, не позволяющие окончательно внедрить данные устройства в клиническую практику. Значимым ограничением является наличие прориетарных форматов получаемых данных у каждого микроскопа, которые затрудняют интеграцию в имеющуюся в учреждении медицинскую сеть. Многие исследователи приходят к выводу о необходимости наличия единого стандарта данных, позволяющего интегрировать WSI с остальными этапами цифровой патологии, а также другими сферами медицины – DICOM стандарта [73, 74]. Gupta Y. и соавт. создали DICOMизирующий конвейр – программу, определяющую прориетарные форматы микроскопов и преобразующую их в DICOM-стандарт [73]. Такие решения позволяют связать микроскопию с остальными методами исследования, метаданными конкретного исследования и другими цифровизированными этапами патологоанатомического исследования, снижая количество возможных ошибок.
Анализ патоморфологических данных
В клинических рекомендациях Американской телемедицинской ассоциации телепатология определена как форма коммуникации между медицинскими специалистами, которая включает передачу патологоанатомических изображений и связанной клинической информации в целях различного клинического применения, включая, но не ограничиваясь, первичными диагнозами, срочными цитологическими исследованиями, интраоперационными консультациями и второго мнения, вспомогательными исследованиями, хранением и деятельностью по оценке качества [75]. Телепатология – новая часть в патологической анатомии, значительно расширяющая ее возможности. Применение инструментов телепатологии позволяет работать с данными из любой точки и при необходимости нескольким специалистам.
Retamero J.A. и соавт. описали опыт создания полностью цифровизированных патологоанатомических лабораторий, включая интеграцию программ, осуществляющих работу с микропрепаратами, в систему данных больницы [76]. С момента внедрения цифровых технологий были проанализированы около 160 000 гистопатологических образцов. Возможность удаленного доступа патологоанатомов данной больницы позволила перераспределить работу с данными в зависимости от компетенций и специализации врачейпатологоанатомов, а не по географическому местоположению. Автора работы отмечают значительное улучшение структуризации информации, а также возможность использования мультидисциплинарного подхода, при котором, например, лечащий хирург и дерматопатолог могли совместно ставить диагноз и выбирать метод лечения. Внедрение технологий по подсчету структур клеток так же значительно облегчило работу специалистов с материалами.
Stathonikos N. и соавт. описали опыт внедрения цифровых технологий в патологоанатомическом отделении Университетского медицинского центра Утрехта (Нидерланды) [74]. В систему цифровой патоморфологии в данной лаборатории входит система микроскопии – сканерымикроскопы; система хранения данных, а также интеграция с информационной платформой медицинского учреждения, включая использование штрихкодов, присваиваемых отсканированному изображению. Для соответствия требованиям, предъявляемым к работе лаборатории и объему анализов – минимум 800 отсканированных изображений в день, были сделаны такие шаги, как выбор микроскопов, работающих с DICOM файлами, использование 4 микроскопов. В настоящее время 90–95% клинических случаев, поступающих в лабораторию, анализируется в цифровом формате. Кроме того, во время пандемии COVID-19 патологоанатомы имели возможность работать с оцифрованными данными, находясь дома. Ограничениями в настоящее время является невозможность проведения цитологических исследований, что связано с недостаточным качеством получаемых изображений, а также отсутствием 3D сканирования. Гематопатология, исследования митозов и микроорганизмов также ограничено в связи с высоким требованием данных процедур к качеству изображения. В ходе работы с отсканированными данными было обнаружено ограничение, связанное с недостаточным фокусом при автоматическом сканировании. Данная проблема делала невозможным анализ изображений и значительно удлиняла процесс работы патологоанатома, поскольку требовала повторного проведения сканирования. Решением проблемы стало создание 10 профилей, к которым могут обращаться микроскоп-сканер с помощью штрихкодов, связанных с метаданными микропрепарата, и таким образом корректировать фокус изображения. Внедрение цифровых технологий в работу патологоанатомической службы позволило создать национальную платформу для обмена данными WSI между патологоанатомическими лабораториями страны, а также группы экспертов, что повлияло на привычный анализ данных в рамках одной лаборатории. Постоянные изменения и появление новых технологий в сфере цифровой патоморфологии также требуют от лаборатории своевременной смены используемых аппаратов, программ и методов.
На Токсикологическом патологическом форуме были обсуждены препятствия и особенности внедрения цифровых технологий в работу патологоанатомических лабораторий [5]. Стремительное развитие цифровой патологии привело к необходимости регулирования работы с данными, создания единых принципов сохранения их целостности. Были выделены ключевые моменты работы с данными: неразрывность данных и метаданных биообразцов; целостность данных должна соблюдаться на всех этапах работы с ними; ресурсы и возможности, направленные на сохранение целостности данных, должны быть соразмерны рискам, в частности риску потери данных.
Использование интеллектуальных инструментов для анализа патоморфологических данных
С каждым днем растет заинтересованность в использовании машинного обучения и, основанного на нем, искусственного интеллекта в медицине. Эти технологии имеют потенциал для решения ряда вопросов, стоящих в этой области. С одной стороны, наблюдается нехватка патологоанатомов в данный момент или прогнозируемом будущем в связи с их выходом на пенсию. Это было отмечено в Китае, странах Африки и ожидается в Европе [77]. С другой стороны, объем биопсий, а значит и патоморфологических изображений растет, появляется потребность в накоплении и анализе этой информации для использования у новых пациентов. Именно поэтому исследователей интересует оцифровка, сбор данных и дальнейшая их обработка с созданием систем распознавания патоморфологических изображений.
Анализ исследований показал, что можно выделить 2 основных подхода к организации процесса обучения модели. Подход с ручной разметкой каждого изображения и подход без детальной аннотации с использованием заключения о слайде. Каждый из вариантов имеет свои преимущества и недостатки.
При первом подходе собирается единая база данных изображений и специалистыпатологоанатомы вручную выделяют области, присваивая им необходимую классификацию (используется градация по Глиссону), а затем на таких размеченных изображениях обучается нейронная сеть [77–79]. Так как данная модель обучается на размеченных специалистом изображениях, а проверяется на тестовой когорте, то ее прогноз сравнивается с результатом патологоанатома и оценивается с использованием коэффициента Каппа Коэна (мера согласия). Например, в статье Arvaniti и соавт. удалось добиться 0,55 и 0,49 коэффициента при сравнении заключений первого и второго специалиста соответственно с прогнозом модели [80]. Безусловно, при таком подходе обучение модели подвержено субъективности оценки изображения патологоанатомом, поэтому появляются исследования, где привлекается более 1-2 патологоанатомов с разным стажем работы и различной глубиной специализации. В одном из исследований были привлечены 6 патологов с различным временем работы (27, 24, 17, 15, 5, 1 лет работы) и различной степенью специализации.
Как было сказано ранее, существует другой подход, менее зависимый от специалистов и трудоемкой разметки каждого слайда. При нем за единицу информации используется заключение об изображении. Это позволяет собирать базы данных, используя диагнозы из лабораторных систем и электронных медицинских карт. Например, в исследовании Campanela и соавт. каждому изображению присваивалось заключение из истории болезни – наличие или отсутствие атипичных клеток [81]. Результаты оказались клинически значимы, достигая AUC (площадь под кривой) больше 0,98. Данный подход требует большего набора данных для обучения, но делает возможным обработку большего объема за счет отсутствия трудоемкой ручной разметки.
Стоит отметить, что причиной вариабельности может выступать не только оценка экспертов, но и параметры оборудования, участвующего в создании цифрового изображения. Например, в статье Campanela и соавт. сравнили результаты прогнозирования на изображениях, оцифрованных Leica Aperio и Philips IntelliSite (1274 и 1784 изображения соответственно) [81]. И выявили снижение на 3% процента AUC для сканнера Philips, сами авторы связывают это с разницей в яркости, контрастности и резкости, которая могла повлиять на производительность, обучаемого алгоритма. Это необходимо учитывать при обучении и испытании интеллектуальных моделей, которые в дальнейшем планируется использовать на других сканерах.
Опрос на 14-ой международной Банфф конференции, в котором приняли участие 42 респондента, показал значительную разницу между применением WSI и искусственного интеллекта в сфере патологической анатомии [4]. Так, искусственный интеллект и глубокое машинное обучение задействованы только в 12% случаев.
Статистический анализ и предиктивная аналитика
Использование цифровых технологий, длительное хранение большого объема данных, возможность передачи и удаленной работы с ними становятся базой для применения полученной информации в статистическом анализе и создания моделей заболеваемости. В настоящее время распространено использование статистических моделей для предикции распространения инфекционных заболеваний [82]. Аналогичные модели могут быть созданы и в других областях при наличии достаточного объема данных.
Цифровая патология обеспечивает получение и хранение большого количества данных, в сравнении с классическими методами патологоанатомического исследования, что становится основой для создания баз данных и их применения для более точных классификаций заболеваний. Цифровизации работы с биологическим материалом и наличие всех данных о пациенте в едином месте упрощает создание отчетов, оценку по уже существующим классификациям и в перспективе расширяет возможности врачапатологоанатома в диагностике [43]. Ассоциация цифровой патоморфологии (The Digital Pathology Association) предлагает использование термина вычислительной патоморфологии (computational pathology – CPATH), которая представляет собой определенный подход к патоморфологии, при котором несколько источников информации о пациенте, включая данные патологоанатомических изображений и метаданные, используются вместе для выявления паттернов и анализа особенностей [83]. Таким образом, для обеспечения этой части патологоанатомического исследования необходимо наличие единой системы сбора данных на всех этапах работы. Качественная фиксация всех этапов позволит получить наиболее полную картину заболевания.
Участие пациента в патоморфологическом исследовании
Известно, что ежегодно теряется 375 миллиардов долларов США из-за недостаточной приверженности пациентов к лечению [84]. Расходы в Европейском союзе достигают 80-125 миллиардов евро [85]. Это вызвано тем, что не приверженность ассоциирована с негативными последствиями для здоровья в ряде хронических заболеваний, включая ухудшение контроля заболеваний, увеличение числа госпитализаций и увеличение заболеваемости и смертности [86, 87, 88]. Такое отношение пациентов к своему лечению согласно исследованиям связано с несколькими факторами, в том числе низкой медицинской грамотностью, отсутствием мотивации и понимания лечения, а так же доверия к врачу [84]. Одним из решений этих проблем являются разнообразные системы электронного здравоохранения, позволяющие пациентам активно использовать информацию о своем здоровье. Примером такого непосредственного вовлечения пациентов в процесс лечения является сбор данных о своем здоровье, который стал проще с появлением мобильных приложений и веб-сайтов [89]. То есть это самостоятельное отслеживание и фиксирование пациентом различных показателей: артериального давления, уровня сахара, режима сна и других. В статье Bailey S. и соавт проанализировали 187 исследований, оценивая, как сбор такой информации отражается на показателях здоровья (массе тела, уровне глюкозы, артериальном давлении), поведении пациентов (физической активности, образе жизни), осведомленности о своем здоровье [90]. В большинстве исследований были выявлены положительные статистически значимые результаты. Исследователей так же интересует, есть ли взаимосвязь между положительными аспектами в лечении и доступом пациентов к собственным электронным картам, онлайн-сервисам коммуникации с врачами. Для ответа на этот вопрос Mold F и соавторы систематического обзора проанализировали 28 исследований групп пациентов с сахарным диабетом, различных по дизайну и составу выборки, но удовлетворяющих критериям включения и исключения [91]. Общие результаты таковы: была выявлена положительная связь между использованием пациентами доступа к медицинским картам и онлайн-системам общения с врачом и улучшением показателей лечения в сравнении с группами обычного лечения. Так же сообщалось, что доступ к записям улучшает совместную работу пациента и врача, помогает принять совместное решение. Было установлено, что пациенты, имеющие онлайндоступ к медицинским картам, были более подготовлены к предстоящим назначениям и приему лекарств. Можно сделать вывод, что электронные системы, дающие пациентам доступ к медицинским картам, повышают уровень доверия к врачу, системе здравоохранения, а значит, к назначаемому лечению. Пациент чувствует себя непосредственным участником процесса и с большей ответственностью относится к назначаемым препаратам.
Не менее значимо и участие пациента в патологоанатомическом исследовании. Lafreniere A. и соавт. предлагают использование сайта для повышения осведомленности пациентов в патологической анатомии и повышении комплаентности. Авторами был разработан сайт MyPathologyReport.ca, на котором публиковались статьи по наиболее часто встречающимся за последние 12 месяцев заболеваниям, написанные доступным для пациентов языком, с объяснением используемой терминологии. С 2017 по 2020 год сайт посетили 14392 человека. Авторы считают, что проинформированный пациент – это активный участник команды лечения (healthcare team) [92]. Другим подходом является использование так называемых «дружественных пациенту» кратких изложений (patient-friendly summary) клинических рекомендаций и патологоанатомических заключений [93, 94].
ОБСУЖДЕНИЕ
С нашей точки зрения было бы правильным представить бизнес-процесс проведения патоморфологического исследования, как некую последовательность событий, возникающих во времени. Первым событием в этой цепочке будет выставление показаний для проведения патоморфологического исследования, и эту цепочку событий инициирует, как правило, врач-клиницист.
Ниже приведены эти события.
1. Выставление показаний к проведению прижизненного патоморфологического исследования
Это один из важных этапов, в котором участвует в основном врач-клиницист. После выставления показаний врач-клиницист может самостоятельно выполнить второй этап исследования, произведя забор тканей, либо направить пациента к другим специалистам для выполнения следующего шага – например, к хирургу.
2. Забор биоматериала
Обращаем ваше внимание, что в контексте данной статьи рассмотрено только прижизненное патологоанатомическое исследование: биопсия с целью диагностики, удаленный материал во время хирургической операции и иной гистологический материал. От качества забора биоптата во много зависит качество всего дальнейшего исследования.
3. Подготовка биоматериала
Этот процесс, как правило, рутинный и представляет собой погружение тканей в консервирующие среды (буферизированный 10% формалин).
4. Транспортировка
Это может быть как перенос из одного помещения в другое, так и перемещение биообразца на большие расстояния – в специализированные патологоанатомические лаборатории.
В подавляющем большинстве случаев все эти этапы, от первого до четвертого, проходят без участия патологоанатома, но в то же время они являются критичными, так как на этих этапах происходит большое количество ошибок.
В сложившейся рутинной практике патологоанатом не только не может повлиять на него, но также крайне редко имеет доступ к клинической информации, которая может повлиять на окончательное его заключение.
Создание и совместное использование (доступ) единой медицинской информационной системе, где храниться исчерпывающая исходная информация о пациенте может решить этот вопрос и дать возможность врачу патологоанатому стать полноценным участников лечебно-диагностического процесса. Это может повысить качество диагностики и, как следствие, лечебного процесса.
Современные цифровые технологии позволяют на первых же этапах обеспечить преемственность и прозрачность начального этапа патоморфологического исследования для патологоанатома и клинициста. Медицинские и телемедицинские, а также иные информационные системы теоретически позволяют алгоритмизировать, протоколировать этот процесс и на начальных стадиях вовлекать в него патологоанатомов, как минимум принимая участие в стандартизации этих процессов.
На данных этапах возможно создание клинических протоколов исследования, которые, благодаря информационным системам, будут обязательны для исполнения клиницистами. Например, врач-уролог принимает решение, что пациенту необходимо выполнить биопсию ПЖ. В зависимости от ряда условий клиницист выбирает из списка возможных протоколов наиболее подходящий: 6, 12- точечная биопсия, с трансректальным или промежностным доступом, таргетная биопсия, сатурационная биопсия, с построением биопсийной карты органа. Затем он посредством программы инициирует конкретный протокол, после чего врачу предлагается определенная последовательность действий, выполняя которые, он заполняет этот протокол. Например, выполняя промежностную сатурационную биопсию, врач должен следовать определенным правилам: каждый биопсийный столбик погружать в транспортировочный контейнер с консервирующей средой, пронумеровывать согласно протоколу, присваивать каждому из контейнеров соответствующий идентификатор. Все эти действия фиксируются в информационной системе. Идентификатор содержит в себе информацию о пациенте и о зоне, из которой взят биопсийный материал. Это важно для качественных результатов и скорости их выполнения – важно строго идентифицировать биоматериал с присваиваемой и соответствующей ему зоной. На этом этапе современные приборы позволяют проводить фото-, видеофиксацию, которая тоже может стать важной частью цифрового протокола. Дефицит кадров, возможные временные затраты на этот процесс могут быть нивелированы правильным бизнес-процессом (алгоритмом) выполнения хирургической операции с забором биоматериала. Использование аппаратнопрограммных решений (специализированные камеры с управлением), правильная эргономика процесса (положение камеры относительно зоны хирургической манипуляции и места упаковки биообразца в контейнер) могут оптимизировать временные ресурсы. Визуальная информация о методе забора, процедуре выполнения является очень важной для патологоанатома при дальнейшей оценке полученного биоматериала. Уже на этом этапе инициации и выполнения биопсии ПЖ технически возможно подключить к операции патологоанатома, который может не только видеть и знать, какой материал готовится к поступлению, а следовательно, и планировать свое время, но также иметь возможность вмешаться в процесс для возможной коррекции выполняемых процедур. Необязательно делать это в онлайн-режиме, так как он является очень ресурсоемким – у врача патологоанатома просто не будет для этого времени. Видеть и знать протокол, по которому выполняется забор биоматериала, уже само по себе является хорошей возможностью для корректировки данной процедуры. На уровне обсуждения таких протоколов возможно повысить качество патоморфологического исследования.
На сегодняшний день в России профессия патологоанатома имеет название «клинический патологоанатом». Таким образом, в его обязанности входит не только оценка макро- и микроскопической картины, но и возможность изучения необходимого объема клинических данных. Цифровые технологии с использованием медицинских и телемедицинских информационных систем позволяют без особых усилий передавать данные, хранящиеся в этих системах, всем участникам процесса патоморфологического исследования. В первую очередь речь идет о клиническом патологоанатоме. Появляются приборы для выполнения так называемых фьюжн исследований (биопсий), когда у клинициста в процессе забора материала имеется доступ к информации с других визуальных и не визуальных источников. Например, при выполнении биопсии ПЖ ультразвуковая картина, полученная с помощью трансректального датчика, может быть сплавлена (фьюжн) с информацией, полученной о ПЖ в ходе МРТ. С использованием такого подхода у хирурга появится возможность выполнять таргетную терапию или сконцентрировать свое внимание на какой-то подозрительной зоне. Для патологоанатома наличие доступа к данной информации также представляется важным и критичным для правильной постановки морфологического диагноза, а также снижает количество повторных биопсий. Можно использовать протокол биопсии, совмещая биоптаты не только со стандартной картой органа, но и с конкретной визуальной информацией, полученной с помощью других устройств (КТ, МРТ, УЗИ). Таким образом, доступ патологоанатома к цифровым данным, содержащим в себе дополнительную визуальную информацию и протокол с фото- и видеофиксацией, значительно расширяет возможности врача, вовлекая его в клинический процесс.
Выстраивание беспрепятственных каналом коммуникации между врачами клиницистами и патологоанатомами на основе электронных инструментов может способствовать процессу формирование единого информационного пространства для команды специалистов, участвующих в судьбе пациента.
Особо стоит отметить важность создания (освоение) единой терминологической базы и подходов к оценке патоморфологических материалов. Клиницисты должны осознанно понимать описание и заключение, которые формируют патологоанатомы и не игнорировать непонятую им информацию. Этому может способствовать простые электронные каналы коммуникации между специалистами, которые в итоге общения должны привести к взаимному пониманию друг друга, так как при общении врачи будут вынужден говорить на одном клиническом языке. Обучение клиницистов основам патоморфологии и совместные научно-образовательные мероприятия позволят сократить понятийный разрыв между с патологоанатомами, а использование дистанционных образовательных технологий может облегчить этот процесс.
5. Пробоподготовка
В этом процессе в рутинной клинической практике как правило принимают участие врач-патологоанатом и лаборанты. И в подавляющем числе случаев в нем не только невозможно участие клинициста, но и его знания и доступ к информации ограничены.
a. Вырезка материала и его фиксация
Дополнительная вырезка тканей осуществляется патологоанатомом или квалифицированным лаборантом, если того требует процесс. На этом этапе биоматериал должен быть зафиксирован вовремя, до начала процессов аутолиза, с использованием необходимого объема фиксатора. Данная стадия на сегодняшний день в ряде лабораторий протоколируется с помощью фото- и видеофиксации биоматериала, а вырезанным тканям присваиваются метки. При правильной организации с первого по четвертый этапы, биоптат должен поступать с уже имеющимся идентификатором. В этом случае патологоанатому или лаборанту достаточно будет лишь отсканировать идентификатор и получить доступ к информации о пациенте и выполненной процедуре в цифровом виде. При наличии единой информационной системы и использовании телемедицинских технологий не существует технологического барьеров для реализации такого подхода.
b. Обезвоживание, проведение по спиртам
В нашем обзоре представлены аппаратнопрограммные решения, которые полностью автоматизируют данный процесс – тканевые процессоры.
c. Заливка парафином с изготовлением парафиновых блоков
Существуют заливочные станции, позволяющие минимизировать количество ошибок, приводящих к порче материала в ходе данной процедуры. Данные устройства могут быть совмещены или являться частью тканевых процессоров.
d. Нарезка микротомом
К сожалению, пока это процесс менее всего автоматизирован. Большей частью она осуществляется вручную лаборантом. В ближайшее время с развитием технологического прогресса можно ожидать появление автоматизированных решений.
e. Окраска с помощью окрасочных станций
f. Заключение под покровное стекло или пленку
В нашем обзоре представлены решения для автоматизации последних двух шагов этапа пробоподготовки. Зачастую именно он является критичным, поскольку при допущении ошибок на этой стадии дальнейшая работа с микроскопом-сканером и даже стандартный анализ с помощью светового микроскопа могут быть затруднены вследствие разнообразных артефактов пробоподготовки.
Уже сейчас на практике используется множество технологических подходов и конкретных решений, позволяющих минимизировать количество ошибок на данном этапе, хотя в будущем еще предстоит получить полностью автоматизированные комбайны, которые единоразово производят весь процесс. Однако в контексте нашей страны очевиден тот факт, что это крайне дорогой с точки зрения оснащения этап. Следовательно, в ближайшее время полная автоматизация этого процесса весьма маловероятна.
В связи с этим возможны два пути решения этой задачи.
Первый путь – создание специализированных, полностью укомплектованных лабораторий. На сегодняшний день такой процесс инициирован в России и ряде других стран, в которых создаются полностью цифровые патоморфологические лаборатории, куда доставляются биоматериалы. Это считается оптимальным и эффективным подходом, самым очевидным решением. Такой путь дает наибольшую эффективность в крупных медицинских центрах (областные онкодиспансеры, региональные клинические больницы) и в ряде крупных частных лабораторий. Но этот подход требует значительных финансовых затрат, максимальной загруженности этих лабораторий, а также логистической доступности для своевременной доставки биоматериалов. Эти три ограничения делают невозможным реализацию такого подхода в ряде удаленных, мало населенных регионов РФ, с низким уровнем финансовой обеспеченности.
Второй путь – создание протоколов пробоподготовки и их оцифровка, то есть заполнение этих протоколов в цифровом виде по мере выполнения, и возможность их контроля и внесения корректировок. Так же уменьшить число ошибок при работе с биоптатом можно с помощью повышения квалификации специалистов, принимающих участие в реализации этих протоколов. В любом случае на этапе обработки биоматериалов для повышения качества и эффективности требуется наличие специальной информационной системы, которая будет включать в себя как минимум фото- и видеофиксацию процессов вырезки, отображение протоколов для лаборантов при проведении всех этапов пробоподготовки, систему идентификации гистоматериалов (формирование QR-кодов для кассет, стекол), отсканированных изображений, печатей штрихкодов. Использование информационной системы на этих этапах позволит фиксировать все этапы от получения тканей в лаборатории до окончательного изготовления микропрепарата, а также сделает возможным отслеживание ошибок с дальнейшей коррекцией протокола или требований к строгому следованию утвержденным правилам. Доступ клинициста к этой информации также полезен в ряде случаев, например, при возникновении спорных вопросов.
6. Полноформатное сканирование патоморфологических стекол (WSI)
Данный этап представляет собой один из самых ярких и значимых способов применения цифровых технологий в патоморфологии, которым, зачастую неоправданно, могут подменять более широкое понятие «цифровая патоморфология». Инструментам, применяемым для оцифровки, посвящена отдельная статья. Стоит отметить тот факт, что как в патоморфологических лабораториях крупных медицинских центров, так и в ряде частных лабораторий рациональным является использование высокопроизводительного (200-400 стекол одновременно) оборудования с учетом загрузки лабораторий. При таком построении бизнес-процессов использование подобных устройств является вполне оправданным и может демонстрировать экономическую выгоду при стартовых затратах на его приобретение. Отдаленные, с небольшой загрузкой патологоанатомические отделения и лаборатории могут использовать оборудование с меньшей производительностью и загрузкой (1-5 стекол одновременно). Здесь разумно использовать небольшие загрузочные аппараты с акцентом на соблюдение цифровых протоколов. Обязательным атрибутом должна быть интеграция программного обеспечения сканеров в медицинские информационные системы, либо экспорт в них получаемых на выходе данных.
Очевидным преимуществом такого подхода будет наличие доступа к информации не только патологоанатома, но и врача-клинициста. Важность перевода этого этапа в цифровой формат подчеркивается дальнейшей возможностью привлечения к анализу оцифрованных данных удаленных специалистов, как патологоанатомов, так и клиницистов. Использование открытых (не проприетарных) форматов оцифровки данных таких как DICOM, позволяют реализовать фьюжн-технологию – объединение оцифрованных патоморфологических данных, например, с данными других методов визуализации (КТ, МРТ). При наличии единой информационной системы и возможностей интеграции и включения этих данных открытость форматов создает новые возможности для прецизионной, топографической диагностики, позволяет отслеживать динамику процесса (при повторении патоморфологического исследования) и, соответственно, повышение качества диагностики и лечения. Преимущества, которые дает описанная нами, фьюжн технология можно также рассмотреть на примере таргетной биопсии ПЖ. Если патологоанатом не имеет информации о том, откуда взята биопсийные столбики ткани, то при подсчете общего процента поражения тканей опухолью, специалист может сделать ошибочное предположение. Наличие у патологоанатома информации о топографии биопсии позволит избежать такую ошибку.
Основные преимущества, которые дает перевод этого этапа в цифровой формат:
- удобство хранения и накопления биообразцов в цифровом виде;
- возможность передачи оцифрованной информации на любые расстояния;
- осуществление телемедицинских консультаций, включая телепатологию;
- концентрация и создание распределенных экспертных центров с наличием узконаправленной специализации (например, уропатолог, специалист по злокачественным заболеваниям предстательной железы);
- возможности дополнительной экспертизы, второго мнения, проверки качества выполнения патоморфологического исследования;
- накопление и создание базы данных патоморфологических исследований. Наличие в этой базе экспертного описания позволяет создать так называемые дата-сеты – источники знаний, на основании которых могут быть построены интеллектуальные системы аналитики;
- создание на основе оцифрованных данных интеллектуальных систем – систем поддержки принятия врачебных решений, от автоматизации описания до постановки патоморфологического диагноза и прогнозной аналитики;
- обучение молодых специалистов и повышение уровня квалификации практикующих патологоанатомов;
- поиск новых знаний. Наибольшая эффективность этого процесса может быть реализована при наличии не только оцифрованных патологоанатомических сканов и заключений, но и клинических данных, включая визуальные данные.
7. Анализ данных
Большая часть исследований на сегодняшний день проводится патологоанатомом с использованием светового микроскопа. Цифровые технологии позволяют изменить подход к этому процессу. Для полноценной работы специалиста достаточно доступа к оцифрованным данным, качественного микроскопа и специализированного монитора с возможностью отображения всех нюансов препарата. Цифровые технологии значительно трансформируют бизнес-процессы по анализу и описанию патоморфологических данных. Врач, находясь в любой географической точке, может получать для анализа только те данные, в которых он является экспертом (суперспециализация), и для уточнения деталей подключать к анализу других специалистов: как патологоанатомов, так и клиницистов, например, лечащего врача.
Хорошие возможности дает такой подход для создания команд (например, туморборд), которые объединяют специалистов разных профилей и разных специализаций для решения конкретной клинической задачи. При реализации такого подхода ожидаемо увеличивается нагрузка на специалистов и в целом на систему здравоохранения, так как при таком подходе в итоговом заключении принимает участие не один специалист, а несколько. Однако это бремя может быть компенсировано преимуществами, которые дает такой подход: 8 правильной диагностикой и выбором тактики ведения пациента.
Стоит отметить важный аспект: цифровые технологии позволяют ускорить процесс получения заключения клиницистом, так как не требуют транспортировки итогов работы патологоанатома, а также упрощают коммуникацию между патологоанатомом и клиницистом за счет применения телемедицинских технологий.
8. Использование интеллектуальных инструментов для анализа оцифрованных данных. Предиктивная аналитика
Это является трендом во всей медицине и открывает новые возможности для повышения качества патоморфологической диагностики, может снижать нагрузку на специалистов за счет автоматизации ряда рутинных процессов при анализе данных, увеличивает пропускную способность специалистов. По этому поводу уже существует множество публикаций, но реально работающие инструменты пока разрознены, и им еще предстоит длительное развитие.
При реализации платформенного подхода на этом этапе важно сделать акценты в сторону автоматизации рутинных процессов, таких как автоматизация описания, количественного подсчета, автоматическое формирование заключений и др. Такие инструменты имеют значительные перспективы для рутинного использования в клинической практике. Создание интеллектуальных инструментов по поиску и анализу отклонений от нормы (патологий) – это отдельное большое поле в автоматизации патоморфологического исследования. Однако ожидать быстрого появления конкретных решений не стоит по той причине, что отклонений от нормы гораздо больше с точки зрения их разнообразия, чем стандартных рутинных процессов. Для каждого отклонения от нормы необходимо создавать свой дата-сет, обучать нейронную сеть (или другой инструмент), создавать законченное решение.
Большие преимущества в разработке интеллектуальных систем можно ожидать при консолидации усилий врачей разных специализаций (патологоанатомов, клиницистов, врачей лучевой диагностики и др.), при использовании стандартизированного формата цифровых данных (медицинская информационная система, DICOM). Здесь появляются возможности не только для автоматизации процесса диагностики, но и для презиционного персонализированного выбора тактики ведения пациента, а также для прогнозной аналитики. Такие решения возможны только лишь при объединении усилий специалистов.
9. Статистический анализ
Наличие полностью оцифрованного бизнеспроцесса выполнения патоморфологического исследования позволяет формировать релевантные отчеты о работе патологоанатомической службы, на основании этих отчетов более точно прогнозировать работу системы, как на уровне конкретного ЛПУ, так и на уровне субъекта и всей страны, а также принимать правильные управленческие решения.
10. Участие пациента в бизнес-процессе патоморфологической диагностики
Все, что происходит в системе здравоохранения, направлено на решение проблемы конкретного человека – пациента. Пациент и его интересы, связанные со здоровьем, являются центром, вокруг которого сосредоточены все усилия системы здравоохранения, так называемый пациентоцентрированный подход.
С другой стороны, владельцем всех данных, которые получены в ходе диагностики и лечения, является сам пациент. Следовательно, со его стороны вполне оправдано ожидать возможности доступа к собственным медицинским данным, включая патоморфологические исследования: как само заключение, так и исходные данные.
В бумажном мире пациенту порой очень сложно получить медицинское заключение и тем более полноценную историю болезни; в цифровом мире при наличии оцифрованных медицинских данных это сделать гораздо проще, организовав специальный доступ к этим данным для пациента и/или его законного представителя. Врачи и медицинские работники иногда опасаются доступа пациента к его данным. На практике же вовлеченность пациента в его историю болезни позволяет получить полноценного участника процесса диагностики и лечения. Однако такой подход требует повышения уровня знания специалистов, тщательности и аккуратности заполнения медицинских данных, так как пациент очень часто более внимательно изучает свою историю болезни, чем это делает врач или надзорный орган.
Вовлеченность пациента и повышение уровня квалификации специалистов совместно может привести к повышению качества результатов медицинского лечения. Эта часть цифровизации требует значительных ресурсов со стороны врача и, в первую очередь, системы здравоохранения (время, уделенное пациенту, уровень знаний специалиста).
Таблица 1. Решения для создания цифровой патоморфологии
Table 1. Solutions for digital pathology development

С точки зрения структурной организации построения цифровой патоморфологии, можно выделить три вектора развития:
1. Создание и развитие специализированных центров, патологоанатомических лабораторий, которые специализируются на полном цикле от поступления биоматериала до получения заключения.
В России наметилась тенденция к созданию таких лабораторий на базе крупных региональных и федеральных ЛПУ, а также появлении лабораторий с частной формой собственности.
2. Использование существующей созданной раннее патологоанатомической службы
При этом подходе требуется укомплектование и переоснащение, дооснащение существующих лабораторий и отделений, построение правильных бизнес-процессов, внедрение протоколов, обучение специалистов и контроль исполнения.
В порядках организации патологоанатомической службы прописаны четыре группы патологоанатомического бюро (отделения), в которых проводится патологоанатомическое исследование. Третья группа – это наиболее маленькие по производительности исследований подразделения. К сожалению, в стандарте оснащения патологоанатомического бюро (отделения) у третьей группы, группы структурных подразделений, не предусмотрено оснащение приборами для оцифровки исследований. Однако это наиболее уязвимая группа подразделений для повышения качества патоморфологических исследования. Для этой группы необходимо оснащение бюджетными цифровыми сканерами и организация правильного бизнес-процесса с использованием единой информационной системы. Именно эта группа может получить наибольшие возможности при использовании цифровых технологий, так как именно в этой части имеется наибольший дефицит кадров, что может быть восполнено за счет оцифровки данных и применения телемедицинских и интеллектуальных технологий.
3. Создание референс-центров
В России на базе федеральных учреждений создано 17 референс-центров, которые объединяют усилия специалистов разных профилей, работающих в этих центах, а также концентрируют современное оборудование с возможностью оцифровки данных [95]. Для их полноценной работы необходимо:
1) обеспечить дооснащение региональных отделений с возможностью получения цифровых данных, либо
2) обеспечить логистику по доставке биоматериалов и проведения полного цикла. С учетом величины территории России и неравномерного распределения населения в ряде регионов реализация логистики без потери качества биоматериалов маловероятна.
Для РФ, где представлены разные модели финансирования здравоохранения, от государственного, ОМС, до покрытия расходов из личных средств граждан, возможно ожидать гармоничного развития всех трех векторов направления без значительной конкуренции за ресурсы.
Уже начаты попытки создания цифровых патологоанатомических платформ [96, 97]. Однако будущее видится за полной оцифровкой всех описанных нами процессов.
ЗАКЛЮЧЕНИЕ
Цифровая патоморфология – это не только оцифровка стекол, но и перевод на цифровую платформу всего процесса, от момента постановки диагноза, выполнения хирургической манипуляции, до анализа цифровых снимков и участия в этом процессе пациента.
Отдельные блоки, которые должны составлять единую цифровую патоморфологическую платформу, уже существуют, и требуется усилие и время, чтобы объединить это в единую цифровую платформу.
Цифровая патоморфологическая платформа позволяет объединить усилия клиницистов, диагностов, патологоанатомов, организаторов здравоохранения и пациентов. Это позволит получить синергию участников для достижения качественной диагностики и правильного выбора тактики лечения и ведения пациента. В этом процессе участвуют не только инструментальные блоки, но и люди.
ЛИТЕРАТУРА
1. Состояние и основные задачи развития патологоанатомической службы Российской Федерации: Отраслевое статистическое исследование за 2020 год.
2. Journal of Pathology Informatics [Electronic resource]. URL: https://www.jpathinformatics.org.
3. Weinstein RS. Prospects for telepathology. Human Pathology 1986;5(17):433–434.
4. Farris AB, Moghe I, Wu S, Hogan J, Cornell LD, Alexander MP, Kers J, et al. Banff Digital Pathology Working Group: Going digital in transplant pathology. American Journal of Transplantation 2020;9(20):2392–2399.
5. Gauthier BE, Gervais F, Hamm G, O'Shea D, Piton A, Schumacher VL, et al. Toxicologic Pathology Forum*: Opinion on Integrating Innovative Digital Pathology Tools in the Regulatory Framework. Toxicologic Pathology 2019;4(47):436–443.
6. WHA58.28 eHealth.
7. Babalola A, Temilola A. Investigating Electronic Medical Record System of Selected Healthcare Institutions in Nigeria. International Journal of Advanced Research in Science, Engineering and Technology 2016;12(3).
8. Raymond L. Improving performance in medical practices through the extended use of electronic medical record systems: a survey of Canadian family physicians. BMC Medical Informatics and Decision Making 2015;1(15):27.
9. Tilahun B. The Ethiopian National eHealth Strategy and its Alignment with the Health Informatics Curriculum. Journal of Health Informatics in Africa 2015(2):2.
10. Li Y.-C. (Jack). Building a National Electronic Medical Record Exchange System – Experiences in Taiwan. Computer Methods and Programs in Biomedicine 2015;1(121):14–20.
11. Vos JFJ, Boonstra A, Kooistra A, Seelen M, Offenbeek M. The influence of electronic health record use on collaboration among medical specialties. BMC Health Services Research 2020;1(20):676.
12. Kostopoulou O. Diagnostic accuracy of GPs when using an early-intervention decision support system: a high-fidelity simulation. British Journal of General Practice 2017;656(67):e201–e208.
13. Kwan JL, Lo L, Ferguson J, Goldberg H, Diaz-Martinez JP, Tomlinson G, Grimshaw JM. Computerised clinical decision support systems and absolute improvements in care: meta-analysis of controlled clinical trials. BMJ 2020;m3216.
14. Mirham L, Hanna J, Yousef GM. Addressing the Diagnostic Miscommunication in Pathology. American Journal of Clinical Pathology 2021;4(156):521–528.
15. Barbieri AL. Fadare Q, Fan L, Singh H, Parkash V. Challenges in Communication from Referring Clinicians to Pathologists in the Electronic Health Record Era. Journal of Pathology Informatics 2018;1(9):8.
16. Gibson BA, McKinnon E, Bentley RC, Mohlman J, Witt BL, Yang EJ. Communicating Certainty in Pathology Reports: Interpretation Differences Among Staff Pathologists, Clinicians, and Residents in a Multicenter Study. Archives of Pathology & Laboratory Medicine 2021.
17. Cho SY, Park SY, Bae YK, Kim JY, Kim EK, Kim WG, Kwon Y. Standardized Pathology Report for Breast Cancer. Journal of Breast Cancer 2021;1(24):1.
18. PЋrez-De-Oliveira ME, Heerden W, Motta ACF, Rodrigues-Fernandes CI, Roma–ach MJ, Agostini M. The need for communication between clinicians and pathologists in the context of oral and maxillofacial diseases. Brazilian Oral Research 2022(36):e008.
19. Sergi CM. Implementing Epic Beaker Laboratory Information System for Diagnostics in Anatomic Pathology. Risk Management and Healthcare Policy 2022(15):323–330.
20. Evans CR., Medina MG., Dwyer AM. Telemedicine and telerobotics: from science fiction to reality. Updates in Surgery 2018;3(70):357–362.
21. Artsen AM, Burkett LS, Duvvuri U, Bonidie M. Surgeon satisfaction and outcomes of tele-proctoring for robotic gynecologic surgery. Journal of Robotic Surgery 2021.
22. OR1TM KARL STORZ Endoskope. [Electronic resource]. URL: https://www.karlstorz.com/ru/ru/karl-storz-or1.htm.
23. VISERA ELITE II — Медицинские системы Olympus. [Электронный ресурс]. URL: https://www.olympus.com.ru/medical/ru/%D0%9F%D1%80%D0%BE%D0% B4%D1%83%D0%BA%D1%86%D0%B8%D1%8F-%D0%B8- %D1%80%D0%B5%D1%88%D0%B5%D0%BD%D0%B8%D1%8F/%D0%9F% D1%80%D0%BE%D0%B4%D1%83%D0%BA%D1%82%D1%8B/Product/ VISERA-ELITE%C2%A0II.html.
24. Chadebecq F, Vasconcelos F, Mazomenos E, Stoyanov D. Computer Vision in the Surgical Operating Room. Visceral Medicine 2020;6(36):456–462.
25. Padoy N. Machine and deep learning for workflow recognition during surgery. Minimally Invasive Therapy & Allied Technologies 2019;2(28):82–90.
26. Das CJ, Razik A, Netaji A, Verma S. Prostate MRI–TRUS fusion biopsy: a review of the state of the art procedure. Abdominal Radiology 2020;7(45):2176–2183.
27. Chhoda A, Rustagi T. EUS-guided needle biopsy for autoimmune pancreatitis. Clinical Journal of Gastroenterology 2020;5(13):669–677.
28. Dahiya N, Patel MD, Young SW. Neck Procedures: Thyroid and Parathyroid. Radiologic Clinics of North America 2020;6(58):1085–1098.
29. Hoffmann J. Ultrasound-Assisted Tumor Surgery in Breast Cancer – A Prospective, Randomized, Single-Center Study (MAC 001). Ultraschall in der Medizin – European Journal of Ultrasound 2019;03(40):326–332.
30. Lerchbaumer MH, Fischer T. Ultrasound fusion biopsy. Der Radiologe 2021;S1(61):11–18.
31. Volders JH, Krekel NMH, Haloua MH, Meijer S, Tol MP. [Ultrasound-guided surgery for breast cancer]. Nederlands Tijdschrift Voor Geneeskunde 2018(162):D2218.
32. Krarup AL. Implementation of a biopsy protocol to improve detection of esophageal eosinophilia: a Danish registry-based study. Endoscopy 2021;01(53):15–24.
33. Bergonti M, Casella M, Compagnucci P, Russo AD, Tondo C. Electroanatomic Mapping System and Intracardiac-Echo to Guide Endomyocardial Biopsy. Cardiac Electrophysiology Clinics 2021;2(13):381–392.
34. Satish P, Simpson B, Freeman A, Giganti F, Kirkham A, Orczyk C, Whitake H. Mapping Contemporary Biopsy Zones to Traditional Prostatic Anatomy: The Key to Understanding Relationships Between Prostate Cancer Topography, Magnetic Resonance Imaging Conspicuity, and Clinical Risk. European Urol 2021;2(80):263–265.
35. Bittner N, Merrick G, Taira Al, Bennett A, Schattel A, Butler W, Galbreath R. Location and Grade of Prostate Cancer Diagnosed by Transperineal Templateguided Mapping Biopsy After Negative Transrectal Ultrasound-guided Biopsy. American Journal of Clinical Oncology 2018;8(41):723–729.
36. Singh PB, Anele С, Dalton E, Barbouti O, Stevens D, Gurung P, Arya M. Prostate Cancer Tumour Features on Template Prostate-mapping Biopsies: Implications for Focal Therapy. European Urology 2014;1(66):12–19.
37. Bauer DR, Otter M, Chafin DR. A New Paradigm for Tissue Diagnostics: Tools and Techniques to Standardize Tissue Collection, Transport, and Fixation. Current Pathobiology Reports 2018;2(6):135–143.
38. Bryant P, Haine N, Johnston J, Ntiamoah P. Application of large format tissue processing in the histology laboratory. J Histotechnol 2019;3(42):150–162.
39. Doolan BJ. The use of cassettes for the collection of nail biopsy specimens. Australasian Journal of Dermatology 2019;3(60):248–250.
40. Sunny N, Thomas A, Manjunath S, Kini U. Modified improvised pre-embedding method for core needle biopsies: A clinicopathologic study. Indian J Pathol Microbiol 2021;64(1):102-106.
41. Fraggetta F, Garozzo S, Zannoni GF, Pantanowitz L, Rossi ED. Routine digital pathology workflow: The Catania experience. Journal of Pathology Informatics 2017;1(8):51.
42. Mandecki W. Electronic p-Chip-based system for identification of glass slides and tissue cassettes in histopathology laboratories. Journal of Pathology Informatics 2018;1(9):9.
43. Pallua JD. The future of pathology is digital. Pathology – Research and Practice 2020;9(216):153040.
44. Brennan PA, Brands MT, Caldwell L, Fonseca FP, Turley N, Foley S, Rahimi S. Surgical specimen handover from the operating theatre to laboratory-Can we improve patient safety by learning from aviation and other high-risk organisations? Journal of Oral Pathology & Medicine 2018;2(47):117–120.
45. Gordy D. Domestic and International Shipping of Biospecimens Methods in Molecular Biology. под ред. W. H. Yong, New York, NY: Springer New York 2019;433–443.
46. Dewhurst RM, Molinari E, Sayer JA. Cell preservation methods and its application to studying rare disease. Molecular and Cellular Probes 2021(56):101694.
47. Merivaara A, Zini J, Koivunotko E, Valkonen S, Korhonen O, Fernandes M, Yliperttula M. Preservation of biomaterials and cells by freeze-drying: Change of paradigm. Journal of Controlled Release 2021(336):480–498.
48. Varma M, Delahunt B, McCluggage WG, Shah VI, Berney M. Macroscopy under the microscope: a critical reappraisal of grossing techniques. Histopathology 2020;7(76):930–933.
49. Dimenstein IB. Grossing Technology Today and Tomorrow. Laboratory Medicine 2020;4(51):337–344.
50. Madrigal E, Le LP. Digital media archive for gross pathology images based on open-source tools and Fast Healthcare Interoperability Resources (FHIR). Modern Pathology 2021;9(34):1686–1695.
51. «Стандартные технологические процедуры при проведении патологоанатомических исследований» Клинические рекомендации Российского общества патологоанатомов 2016.
52. Fraggetta F, Caputo A, Guglielmino R, Pellegrino MG, Runza G, L'Imperio V. A Survival Guide for the Rapid Transition to a Fully Digital Workflow: The «Caltagirone Example». Diagnostics 2021;10(11):1916.
53. Приказ Министерства здравоохранения РФ от 6 июня 2013 г. N 354н "О порядке проведения патолого-анатомических вскрытий" [Электронный ресурс]. URL: https://minzdrav.gov.ru/documents/8041-o-poryadke-provedeniya-patologo-a....
54. Leica ASP6025 S [Electronic resource]. URL: https://www.leicabiosystems.com/ histology-equipment/tissue-processors/asp6025-s/.
55. HistoCore PELORIS 3 Premium Tissue Processing System [Электронный ресурс]. URL: https://www.leicabiosystems.com/histology-equipment/tissueprocessors/his....
56. Tissue-Tek AutoSection® Automated Microtome [Electronic resource]. URL: https://www.sakuraus.com/Products/Microtomy/Tissue-Tek-AutoSectionAutoma....
57. Histo-Tek® SL Slide Stainer. [Электронный ресурс]. URL: https://www.sakuraus.com/Products/Staining/Histo-Tek-SL-Slide-Stainer.html.
58. Tissue-Tek® GlasTM g2 Automated Glass Coverslipper. [Electronic resource]. URL: https://www.sakuraus.com/Products/Coverslipping/Glas-g2.html.
59. Tissue-Tek Genie® Advanced Staining System [Electronic resource]. URL: https://www.sakuraus.com/Products/Advanced-staining/Tissue-Tek-Genie-Adv....
60. BenchMark ULTRA IHC/ISH System [Electronic resource]. URL: https://diagnostics.roche.com/global/en/products/instruments/benchmark-u....
61. Tissue-Tek Film® Automated Coverslipper [Electronic resource]. URL: https://www.sakuraus.com/Products/Coverslipping/Prisma-Film.html.
62. Automatic Tissue Processor Donatello Series 2 [Электронный ресурс]. URL: https://www.diapath.com/product/tissue-processors-donatello-series-2- sdsdn9000-2106.
63. Tissue-Tek® Cryo3® Flex Cryostat [Electronic resource]. URL: https://www.sakuraus.com/Products/Cryotomy/Tissue-Tek-Cryo3-Flex-Cryosta....
64. Histo-Tek® Mini Stainer [Electronic resource]. URL: https://www.sakuraus.com/Products/Staining/Histo-Tek-Mini-Stainer.html.
65. Leica IP S Inkjet Printer for Microscope Slides [Electronic resource]. URL: https://www.leicabiosystems.com/histology-equipment/specimen-labeling-pr....
66. Leica IP C Inkjet Printer for Tissue Cassettes [Electronic resource]. URL: https://www.leicabiosystems.com/histology-equipment/specimen-labeling-pr....
67. HistoCore PERMA S Slide Printe [Electronic resource]. URL: https://www.leicabiosystems.com/histology-equipment/specimen-labeling-pr....
68. Liu Y, Levenson RM, Jenkins MW, Over S. The American Journal of Pathology 2021;S0002944021004715.
69. Liu JTC, Glaser AK, Bera K, True LD, Reder NP, Eliceiri KW, Madabhushi A. Harnessing non-destructive 3D pathology. Nature Biomedical Engineering 2021;3(5):203–218.
70. Department of Information and Internet Technologies at Sechenov University. Digital pathomorphology: creation of an automated microscopy system. Russian Journal of Telemedicine and E-Health 2021;4(7):27–47.
71. Huron Digital Pathology. [Electronic resource]. URL: https://www.hurondigitalpathology.com.
72. Aperio AT2. [Electronic resource]. URL: https://www.leicabiosystems.com/ digital-pathology/scan/aperio-at2/.
73. Gupta Y, Costa C, Pinho E, Silva LB. DICOMization of Proprietary Files Obtained from Confocal, Whole-Slide, and FIB-SEM Microscope Scanners. Sensors 2022;6(22):2322.
74. Stathonikos N, Nguyen TQ, Diest PJ. van Rocky road to digital diagnostics: implementation issues and exhilarating experiences. Journal of Clinical Pathology 2021;7(74):415–420.
75. Pantanowitz L, Dickinson K, Evans AJ, Hassell LA, Henricks WH, Lennerz JK, Lowe A. American Telemedicine Association clinical guidelines for telepathology. Journal of Pathology Informatics 2014;1(5):39.
76. Retamero JA, Aneiros-Fernandez J, Moral RG. del Complete Digital Pathology for Routine Histopathology Diagnosis in a Multicenter Hospital Network. Archives of Pathology & Laboratory Medicine 2020;2(144):221–228.
77. Strљm P, Kartasalo K, Olsson H, Solorzano L, Delahunt B, Berney DM, Bostwick DG. Artificial intelligence for diagnosis and grading of prostate cancer in biopsies: a population-based, diagnostic study. The Lancet Oncology 2020;2(21):222–232.
78. Litjens G, Sanchez CI, Timofeeva N, Hermsen M. Deep learning as a tool for increased accuracy and efficiency of histopathological diagnosis. Scientific Reports 2016;1(6):26286.
79. Nir G, Karimi D, Goldenberg SL, Fazli L, Skinnider BF, Tavassoli P, Turbin D. Comparison of Artificial Intelligence Techniques to Evaluate Performance of a Classifier for Automatic Grading of Prostate Cancer From Digitized Histopathologic Images. JAMA Network Open 2019;3(2):e190442.
80. Arvaniti E, Fricker KS, Moret M, Rupp N, Hermanns T, Fankhauser C, Wey N. Automated Gleason grading of prostate cancer tissue microarrays via deep learning. Scientific Reports 2018;1(8):12054.
81. Campanella G, Hanna MG, Geneslaw L, Miraflor A, Silva VWK, Busam KJ, Brogi E. Clinical-grade computational pathology using weakly supervised deep learning on whole slide images. Nature Medicine 2019;8(25):1301–1309.
82. Yadav SK, Akhter Y. Statistical Modeling for the Prediction of Infectious Disease Dissemination with Special Reference to COVID-19 Spread. Frontiers in Public Health 2021;(9):645405.
83. Abels E, Pantanowitz L, Aeffner F, Zarella M. Computational pathology definitions, best practices, and recommendations for regulatory guidance: a white paper from the Digital Pathology Association. The Journal of Pathology 2019;3(249):286–294.
84. Car J, Tan WS, Huang Z, Sloot P, Franklin BD. eHealth in the future of medications management: personalisation, monitoring and adherence. BMC Medicine 2017;1(15):73, s12916-017-0838–0.
85. Boven JF van, Tsiligianni I, Potočnjak I, Mihajlović J, Dima AL, Makovec UN. European Network to Advance Best Practices and Technology on Medication Adherence: Mission Statement. Frontiers in Pharmacology 2021(12):748702.
86. Du L, Cheng Z, Zhang Y, Li Y, Mei D. The impact of medication adherence on clinical outcomes of coronary artery disease: A meta-analysis. European Journal of Preventive Cardiology 2017;9(24):962–970.
87. Gourzoulidis G, Kourlaba G, Stafylas P, Giamouzis G, Parissis J, Maniadakis N. Association between copayment, medication adherence and outcomes in the management of patients with diabetes and heart failure. Health Policy 2017;4(121):363– 377.
88. Simpson SH, Lin M, Eurich DT. Medication Adherence Affects Risk of New Diabetes Complications: A Cohort Study. Annals of Pharmacotherapy 2016;9(50):741–746.
89. Reading MJ, Merrill JA. Converging and diverging needs between patients and providers who are collecting and using patient-generated health data: an integrative review. Journal of the American Medical Informatics Association 2018;6(25):759–771.
90. Bailey SC, Wallia A, Wright S, Wismer GA, Infanzon AC, Curtis LM. Electronic Health Record–Based Strategy to Promote Medication Adherence Among Patients With Diabetes: Longitudinal Observational Study. Journal of Medical Internet Research 2019;10(21):e13499.
91. Mold F, Raleigh M, Alharbi NS, Lusignan S. The impact of patient online access to computerized medical records (CMR) and services for Type 2 Diabetes: systematic review. (Preprint). Journal of Medical Internet Research 2017.
92. Lafreniere A, Purgina B, Wasserman JK. Putting the patient at the centre of pathology: an innovative approach to patient education— MyPathologyReport.ca. Journal of Clinical Pathology 2020;8(73):454–455.
93. Andrews DB, Lalani T. Patient-Friendly Summary of the ACR Appropriateness Criteria: Prostate Cancer—Pretreatment Detection, Surveillance, and Staging. Journal of the American College of Radiology 2019;1(16):e1.
94. Rooney SP, Hoffman S, Perrin JC, Milliron KJ, Nees AV, Jorns JM. Patient-friendly pathology reports for patients with breast atypias. The Breast Journal 2018;5(24):855–857.
95. Приказ Министерства здравоохранения РФ от 25 декабря 2020 года N 1372 «Об организации функционирования референс-центров иммуногистохимических, патоморфологических и лучевых методов исследований на базе медицинских организаций, подведомственных Минздраву РФ». [Order of the Ministry of Health of the Russian Federation of December 25, 2020 N 1372 «About the organization of the functioning of reference centers for immunohistochemical pathomorphological and radiation research methods based on medical organizations subordinate to the Ministry of Health of the Russian Federation»].
96. UNIM. [Electronic resource]. URL: https://unim.su. 97. SECTRA. [Electronic resource]. URL: https://medical.sectra.com/solutionarea/digital-pathology/. 98. Tissue-Tek Prisma® Plus Automated Slide Stainer. [Electronic resource]. URL: https://www.sakuraus.com/Products/Staining/Tissue-Tek-Prisma-Plus.html.