Законодательное регулирование ПО в медицине в США
Среди завершающих мероприятий в рамках конгресса по телемедицине была сессия, которую посетил Степан Красняк – медицинский журналист EverCare, посвященная законодательному регулированию программного обеспечения, связанного с оказанием телемедицинской помощи. Спикер рассказывал о том, как американское управление по надзору за лекарственными средствами и пищевыми продуктами FDA регулирует телемедицинское программное обеспечение. В целом, в Америке программное обеспечение, связанное с телемедициной, а также многие другие типы программного обеспечения сертифицируются и управляются как медицинские устройства.
С этих позиций спикер дал определение, что же такое медицинское устройство с точки зрения FDA – американского управления по надзору за лекарственными средствами и пищевыми продуктами. Как определяет FDA, медицинское устройство – это инструмент, аппарат, внедрение, имплантат, реагент или любой иной механический или немеханический компонент, часть или приложение, которое предполагается к использованию для диагностики различных заболеваний или иных состояний, для лечения и облегчения состояний, для предотвращения заболевания у людей или животных, которое также не достигает своих целей через химическое действие на тело человека, т.е. не является при этом лекарством.
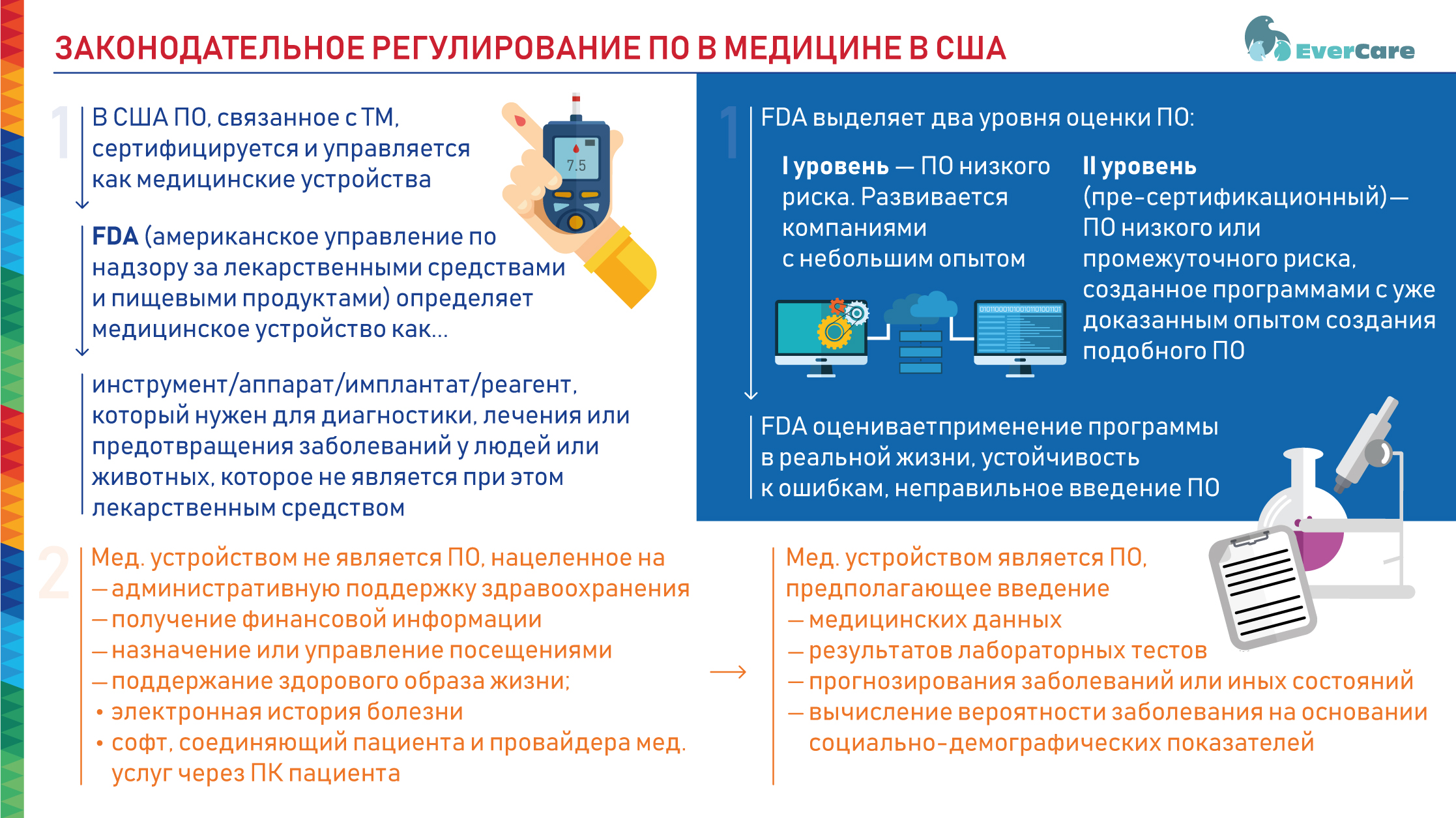
С этой точки зрения под определение медицинских устройств попадают несколько категорий программного обеспечения. В частности, этот термин не должен включать программное обеспечение, нацеленное на административную поддержку процесса здравоохранения, включая получение финансовой информации или, например, назначение или управление посещениями, поддержание здорового образа жизни. Кроме того, медицинским устройством не является так называемая electronic health records, или электронная история болезни. Не является программным обеспечением и софт, соединяющий пациента и провайдера медицинских услуг через собственный компьютер пациента путем видеочата или иных сообщений.
Однако при этом медицинским устройством считается программное обеспечение, предполагающее введение медицинских данных, результатов лабораторных тестов, а также исход, применение которого включает в себя развитие прогнозирования заболеваний или иных состояний, связанных со здоровьем. Например, % вероятности возникновения того или иного заболевания у пациента, или медицинский калькулятор.
Также программным обеспечением является вычисление вероятности заболевания на основании не только лабораторных тестов, но и социально-демографических показателей. FDA разработало специальную систему оценки такого программного обеспечения, которая подразделяет софт на два уровня. Первый уровень – это программное обеспечение низкого риска, которое развивается компаниями, имеющими небольшой опыт. Второй – это пре-сертификационный уровень, связанный с программным обеспечением низкого или промежуточного риска, в основном созданное программами с уже доказанным опытом создания подобного программного обеспечения.
В ходе этих тестов оценивается устойчивость функционирования программы, а также – влияние исхода в применении этого программного обеспечения, т.е. результатов применения для принятия конкретного решения, связанного со здоровьем человека.
При этом процесс пре-сертификации подразделяется на несколько частей. Прежде всего, оценивается безопасность пациента – это то, на что изначально была настроена вся функция FDA. Второе – это качество продукта, т.е. насколько продукт способен выполнять свою функцию доказательства эффективности его применения. Третье – это клиническая ответственность, т.е. насколько клиницисты, применяющие данный продукт, смогут ответственно подходить к диагностике или лечению заболеваний при использовании данного телемедицинского программного обеспечения. Следующий компонент – кибербезопасность. Сейчас вопросы безопасности программного обеспечения в США играют огромную роль, и это в том числе относится к телемедицинскому программному обеспечению, т.к. часто передаются персональные данные, имеющие огромную ценность. Также оценивается проактивная культура, т.е. способность программы к обновлению и постоянной модернизации функций.
Также FDA оценивает, как программа может применяться в реальной жизни, какую она имеет устойчивость к ошибкам, а также – насколько возможно неправильное введение или интерпретация результатов применения этого программного обеспечения.
При этом на производителя программного обеспечения, которое классифицировано как медицинское устройство, налагаются иные ограничения. Сам производитель становится классифицированным как производитель медицинского оборудования с соответствующим регулированием. Поэтому спикеры отмечали: если Вы не хотите стать производителем медицинского оборудования, внимательно следите за тем, чтобы ваше программное обеспечение не несло таких функций.
Вопросы регулирования программного обеспечения в области телемедицины – один из основных моментов деятельности в этой области. Данный опыт мог бы быть полезен для разработки соответствующих актов в том числе и в Российской Федерации.
Также выпуски новостей с международной конференции ATA 19 будут доступны в формате АУДИО-КНИГИ!