Цифровое будущее лечения рака. Как технологии меняют здравоохранение в сфере онкологии
Нет ничего более ценного в лечении рака, чем ранняя диагностика и персонализация лечения, которые никогда не казались более возможными, чем сейчас, с новыми разработками программного обеспечения и цифровых систем.
Лечение рака любого типа печально известно тем, что оно уникально для каждого отдельного пациента, даже если все аспекты заболевания идентичны, а это значит, что при лечении этого заболевания решающее значение имеет персонализация медицинского лечения. Поэтому неудивительно, что в онкологии цифровая медицина играет ключевую роль в адаптации рецептов к конкретным потребностям, в улучшении диагностики и лечения рака, а также в облегчении общего ухода за пациентами.
С внедрением в 1990-х годах принципа виртуальной микроскопии удалось добиться быстрого прогресса в развитии радиологии рака благодаря массовым исследованиям и анализу, чему способствовала эта ранняя форма цифрового здравоохранения. Область радиологии смогла претерпеть преобразования, необходимые для появления на рынке массовых облачных хранилищ. Это позволило передавать цифровые данные на большие расстояния, получить доступ к прошлым исследованиям одного и того же пациента или аналогичных случаев для оценки и исследования, сравнить нескольких случаев одновременно, а также в целом повысить эффективность, с которой ученые теперь могут проводить свою работу и аннотировать ее результаты. Но цифровая радиология - это не единственная сфера здравоохранения, где современные технологии смогли предоставить значительную помощь врачам.
Диагностика
Диагностика всегда играла важную роль в онкологии, ведь от своевременного обнаружения заболевания зависит результативность лечения этой страшной болезни. С появлением новых цифровых разработок в сфере диагностики рака ситуация начала меняться к лучшему, хотя и внедрение таких инструментов в клиническую практику по разным причинам осуществляется очень медленно. Здесь мы хотим познакомить вас с несколькими современными решениями, которые могут совершить революцию в этой сфере.
Диагностика рака легких
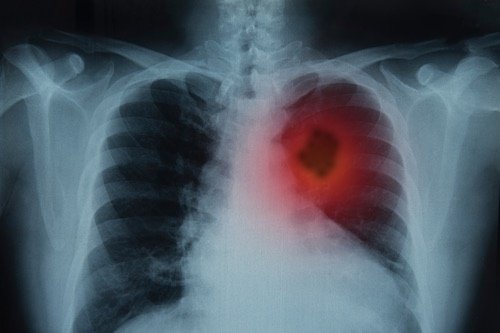
Сейчас для этого используют одновременное проведение компьютерной и позитронно-эмиссионной томографии, что позволяет видеть легкие, их анатомическую структуру и функциональные характеристики, а также очаги поражения в этом органе.
Чтобы упростить эту процедуру и сделать более дешевой, разработчики компаний Future Processing и NVIDIA, работая при сотрудничестве с экспертами в сфере расшифровки медицинских изображений, разработали программное обеспечение на базе алгоритмов искусственного интеллекта, позволяющее получать больше информации из КТ-сканов. Новое решение этих компаний, фокусирующееся на диагностике рака легких, позволяет медицинским специалистам при диагностике использовать только КТ-сканы, не применяя более дорогостоящую позитронно-эмиссионную томографию. Программа позволяет автоматически выделять раковые поражения в изображениях, существенно экономя время радиологов и врачей. Кроме этого, система позволяет измерять распространение опухоли по мере ее развития.
Новая технология не только упрощает процесс, но и позволяет снизить количество ошибочных диагнозов и сэкономить значительные средства.
"Жидкостная биопсия"

Шотландская компания BioCaptiva разработала технологию "жидкостной биопсии", которая может существенно упростить и улучшить раннюю диагностику и мониторинг трудно обнаруживаемых раковых заболеваний.
BioCaptiva разработала медицинское устройство, которое улавливает циркулирующую в крови пациентов свободную ДНК (cfDNA)1 в гораздо больших количествах, чем это возможно при действующих стандартах однократного взятия крови, преодолевая значительное ограничение на проведение жидкостной биопсии раковых опухолей. Прибор, получивший название BioCollector, работает вместе со стандартным устройством для афереза2, фильтруя cfDNA из кровеносной системы пациента.
Устройство может обеспечить возможность выявления рака на ранней стадии у пациентов без необходимости проведения хирургической биопсии и обещают новые подходы к мониторингу и выявлению рецидивов заболеваний, которые в настоящее время невозможны.
BioCaptiva планирует провести клинические испытания своей технологии и получить разрешение на использование от регулирующих органов до конца 2024 года.
Оценка колоректальных полипов
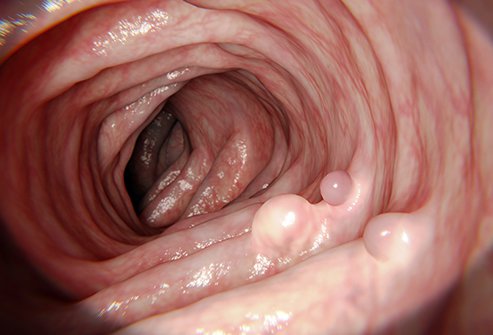
Компания Olympus сертифицировала в США свою систему Narrow Band Imaging (NBI), предназначенную для оценки возможности небольших колоректальных полипов перерасти в раковую опухоль. NBI представляет собой технологию оптической визуализации, которая улучшает видимость сосудов и рисунков поверхности на слизистой оболочке.
Используя NBI во время колоноскопии для выявления рака толстой кишки, врачи могут с высокой степенью уверенности делать гистологические прогнозы для полипов размером в 5 мм и менее, известных как мельчайшие полипы, во время скрининговой колоноскопии.
Эндоскописты, использующие систему NBI, при диагностике продемонстрировали 93% чувствительность, 85% специфичность и более 90% точность определения отрицательного результата при предсказании аденоматозной гистологии миниатюрных полипов во время колоноскопии.
Диагностика рака по моче
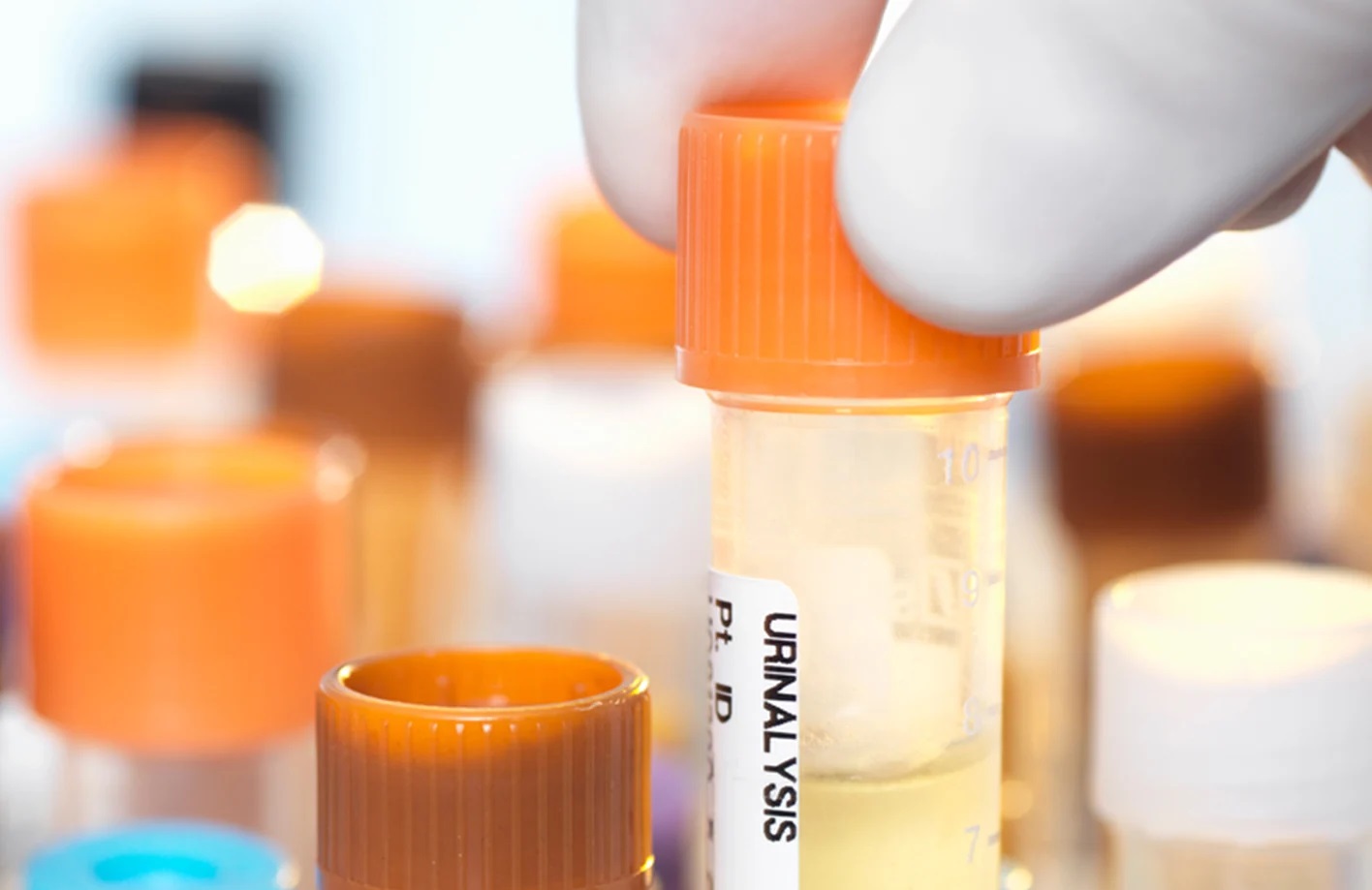
Специалисты корейского института науки и технологий (KIST) разработали методику диагностики рака простаты на основе анализа мочи в течение всего двадцати минут с почти 100%-ой точностью. Команда исследователей разработала эту методику, интегрировав метод анализа на базе искусственного интеллекта в сверхчувствительную биосенсорную систему.
Ученые разработали сверхчувствительную полупроводниковую сенсорную систему, способную одновременно измерять количество четырех онкологических факторов в моче для диагностики рака простаты. Они обучили алгоритм искусственного интеллекта, используя корреляцию между четырьмя раковыми факторами, которые были получены с помощью разработанного ими сенсора.
Как неинвазивный метод такой тест с использованием мочи удобен для пациентов и не нуждается в инвазивной биопсии, тем самым позволяя диагностировать рак без побочных эффектов. Тем не менее, поскольку концентрация раковых факторов в моче низкая, биосенсор на основе мочи до сих пор был использован для классификации групп риска, а не для точного диагноза.
Искусственный интеллект для выявления сигнатур рака
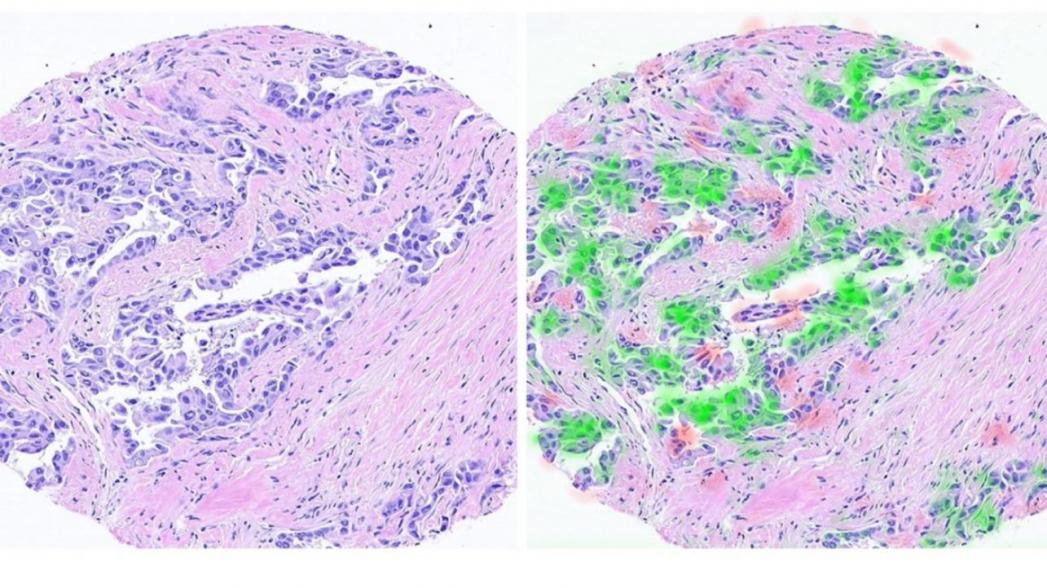
Как уникальна каждая подпись человека, так уникальна и каждая раковая опухоль. Ученые Израильского технологического института Technion использовали искусственный интеллект и большие массивы данных для определения уникальных сигнатур определенных раковых клеток. Полученная в результате технология, получившая название "компьютеризированный патологоанатом", способно значительно ускорить развитие персонализированного лечения рака.
Исследователи работали с цифровыми изображениями образцов биопсии рака молочной железы. Новая технология извлекает молекулярную информацию из формы клеток (морфологии) и их окружения.
С помощью инструментов обработки изображений и систем на основе алгоритмов искусственного интеллекта ученые смогли предсказывать молекулярный профиль раковых клеток, просто "глядя" на ткани на стандартных биопсийных снимках. По словам ученых, они научились определять "подпись", которую рак оставляет в тканях.
Определить 13 типов рака по одной капле крови

Японская компания Toshiba разработала новый метод определения рака и портативный прибор на базе специализированного чипа. Эта технология способна определить рак даже на самых ранних стадиях заболевания. Для анализа требуется только одна капля крови и около двух часов. Точность выявления рака составляет 99%.
Метод основан на идентификации типов и концентраций малых некодирующих молекул РНК, которые секретируют в крови раковые клетки.
Тест способен диагностировать 13 видов рака, включая рак желудка, пищевода, легких, печени, желчевыводящих путей, поджелудочной железы, кишечника, яичников, простаты, мочевого пузыря и молочной железы, а также саркомы и глиомы.
Стоимость тестирования составляет примерно $180 или даже меньше.
Для вывода системы на рынок компании потребуется еще несколько лет на проведение расширенного тестирования и сертификацию в регулирующих органах.
Лечение

Методы лечения онкологических больных меняются на нашей глазах. В клиниках начали использовать хирургические роботы с наборами специализированных инструментов, позволяющих проводить точные операции на разных органах. Лечение рака стали проводить все более точными и персонализированными методами - постепенно отказываясь от "ковровых бомбардировок" химио- и радиотерапии с неопределенными временными характеристиками и дозами. Современные клиники в развитых странах стали использовать препараты химиотерапии, наиболее подходящие конкретному пациенту и подобранные с учетом генетического профиля пациента. Появились новые методы визуализации, позволяющие точно определять границы опухоли во время ее удаления, что предоставляет возможность удалить все ее ткани, не затрагивая при этом большие области здоровых тканей и не нанося таким образом значительный ущерб здоровью человека. Мы хотим представить вам несколько современных методов лечения рака, которые постепенной начинают использоваться в клиниках.
Ультразвук для точной абляции опухоли
Мощная ультразвуковая терапия в настоящее время используется для разрушения опухолевых тканей, в том числе опухолей предстательной железы и матки. Тем не менее, этот метод может также повредить здоровые ткани, так как он генерирует большое количество тепла, поэтому ультразвуковое поле должно быть жестко контролируемым, чтобы ограничить его только областью опухоли. Это особенно трудно при опухолях головного мозга, так как череп искажает поле.
Исследователи из Германии разработали метод создания ультразвуковых полей высокого разрешения, способный повысить эффективность ультразвуковой терапии и адаптировать ее к индивидуальным потребностям пациентов. Методика предусматривает прохождение ультразвуковых волн через воду, где пузырьки водорода помогают преобразовать волны в желаемые формы. Происходит это из-за того, что, в то время как ультразвуковая волна беспрепятственно проходит через жидкость, она полностью отражается воздушными пузырьками.
Ученые разработали миниатюрный чип, на котором они могут расщеплять воду для образования пузырьков водорода по определенной схеме. Затем они могут послать ультразвуковую волну через чип, и когда она сталкивается с пузырьками, то излучение преобразуется в желаемую форму, позволяя очень точно ограничить воздействие ультразвука границами опухоли.
Имплантат с помпой для химиотерапии в мозгу

Рецидив опухоли мозга после хирургической резекции происходит достаточно часто. Трудно удалить все следы опухоли, не причинив значительного вреда здоровым тканям головного мозга, поэтому для многих пациентов рецидив является неизбежным. Проведение системной химиотерапии ограничено ее побочными эффектами и наличием гематоэнцефалического барьера головного мозга, который не позволяет пройти через него всем химиотерапевтическим препаратам.
Ученые из университета Линчепинга (Швеция) и Медицинского университета Граца (Австрия) разработали миниатюрную электрическую помпу, которая может точно доставлять химиотерапевтические препараты в мозг. Эта помпа имплантируется в место резекции опухоли головного мозга для проведения локализованной химиотерапии в течение длительного времени.
Это устройство обеспечивает более контролируемый ввод лекарств в зоне резекции опухоли и предназначено для ввода гемцитабина - эффективного химиотерапевтического препарата, который не может пройти через гематоэнцефалический барьер мозга.
Устройство представляет собой органический электронный ионный насос. Он использует электрический ток для точной доставки положительно заряженного гемцитабина по ионному транспортному каналу. Такому насосу требуется лишь небольшой ток, что выгодно с точки зрения безопасности при проведении терапии в мозгу.
Микророботы - убийцы опухоли
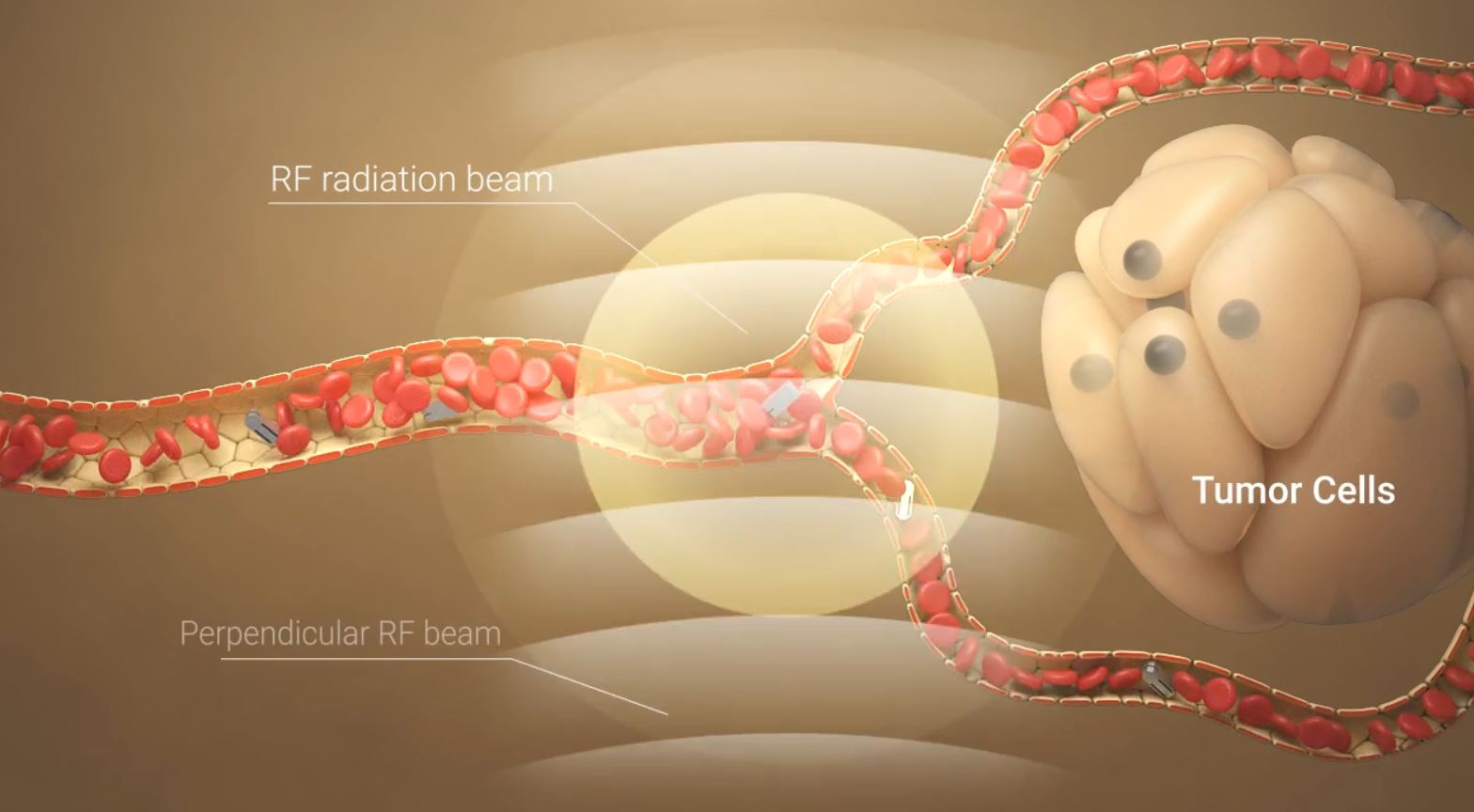
Ирландская компания Elbe Valley Medical разработала технологию, которая представляет собой нанороботов размером 50-100 нм, которые способны блокировать кровоток в области тканей тела, окружающих опухоли.
Когда находящиеся в крови миниатюрные устройства оказываются в области вокруг опухоли, а цель им указывается радиочастотными волнами, они начинаю расправлять "щупальцы", что позволяет закрепить нанобота в капилляре и заблокировать "его телом" кровоток, т.е. вызвать окклюзию на уровне кровеносных капилляров в интересующей ткани.
Такая целенаправленная активация спасает остальной организм от любых побочных эффектов. Окклюзия опухолевых кровеносных капилляров предотвращает доступ эритроцитов к нездоровым тканям, что приводит к увеличению гипоксии в опухоли и, в конечном счете, к ее умиранию. 20-минутное лечение контролируется с помощью технологии МРТ. За это время находящиеся в этой области ткани и опухоли отмирают, радиоволновое поле отключается, "щупальцы" наноробота убираются и возобновляется нормальное кровообращение.
Такая способность сдерживать активность нанороботов на определенной, ограниченной площади увеличивает положительный эффект лечения и минимизирует повреждение более широких участков тела, как это может произойти при обычном облучении и химиотерапии.
Клинические испытания технологии запланированы на 2023 год.
Заморозить опухоль
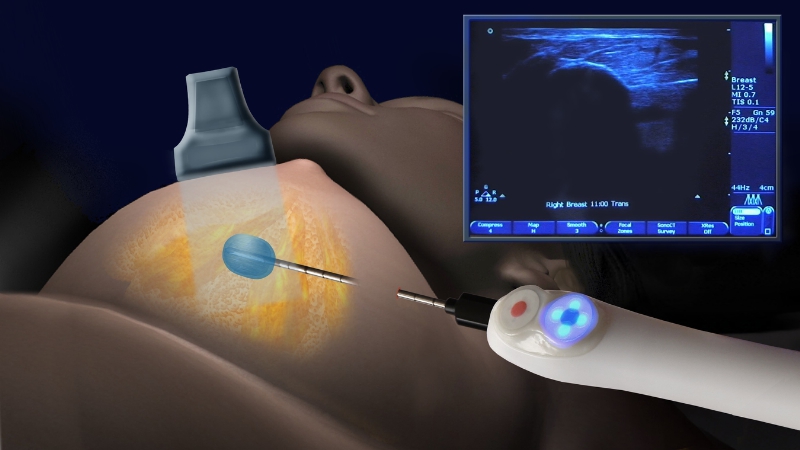
Технология, разработанная компанией IceCure Medical, уничтожает опухоли путем их замораживания в ходе минимально инвазивной процедуры без необходимости проведения хирургического вмешательства или госпитализации. В устройстве ProSense используется криоабляционная терапия на основе жидкого азота для лечения опухолей путем их замораживания, уделяя основное внимание раку молочной железы, почек и легких. Эта технология является безопасной и эффективной альтернативой больничному хирургическому удалению опухолей, которое легко выполняется за относительно короткое время.
Недавно Управление по контролю за продуктами и лекарствами США (FDA) присвоило этому устройству статус "Прорывной технологии".
"Умные" персональные устройства в лечении рака
Изменения в ландшафте онкологической помощи включают также переход к уходу на дому или в амбулаторных условиях с участием самих пациентов и их родственников, ухаживающих за больными. Эти изменения также повлияли на тип и объем информации, необходимой пациентам и лицам, ухаживающим за ними, а также на тип потребностей в медицинской помощи, которые должны удовлетворяться медицинскими работниками. Наконец, переходные процессы в рамках системы здравоохранения могут также создать брешь в уходе, с которой пациенту придется справляться самостоятельно или при минимальной поддержке. Эти изменения привели к появлению инновационных технологических решений для поддержки пациентов в течение всего периода лечения рака.
Носимые устройства, стали играть решающую роль в оказании помощи пациентам в лечении рака. Исследования пришли к выводу, что включение данных об общей физической форме с использованием, например, браслета Microsoft Band является очень реалистичным способом сокращения незапланированных госпитализаций. Часто химиотерапия в сочетании с самой болезнью вызывает у пациентов тошноту - проблему, которую можно решить с помощью простого фитнес-режима, легко контролируемого с помощью носимых устройств и подключенных к приложениям для регистрации данных на смартфонах.
Другие "умные" технологии, такие как iPhone, также становятся эффективными инструментами в онкологии, например, при обнаружении опухолей. Компания Butterfly Network разработала систему ультразвуковой визуализации, которая поставляется с датчиком, подключаемым к iPhone. Это в сочетании с приложениями искусственного интеллекта, которые работают в тандеме с УЗИ-сканером, может лучше помочь экспертам в интерпретации диагнозов и, следовательно, определении лечения.
Сегодня, в условиях, когда цифровые технологии в области здравоохранения начинают предлагать более доступные и менее инвазивные решения по лечению рака, потенциал создания целостной и эффективной модели борьбы с раком представляется все более вероятным с каждым днем в нашу цифровую эпоху.
Прогнозирование
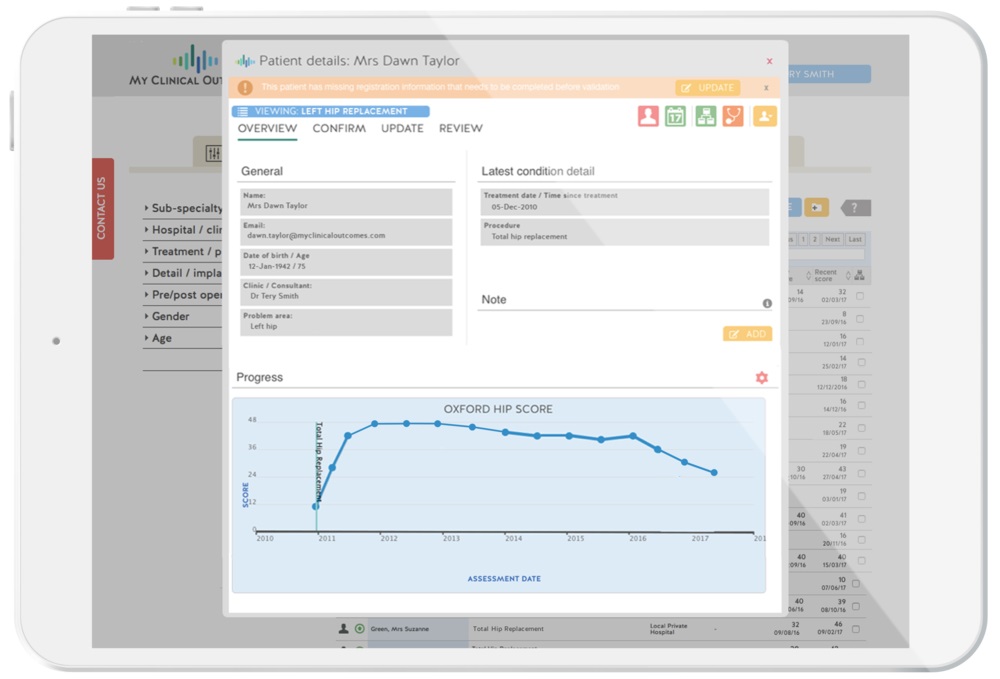
Портал My Clinical Outcomes (MCO) является веб-платформой, которая поощряет пациентов проводить регулярные измерения и самоанализ для оценки их состояния в управляемом формате, открывая эти данные для врачей, чтобы обеспечить регулярный, удаленный мониторинг и анализ проводимого лечения. В настоящее время эта платформа, уже используемая в Шотландии, предназначена для пациентов с любым типом рака, на основе которой эксперты могут оценить эффективность лечения и внести соответствующие коррективы.
Британский эквивалент МСО использует аналогичные методы с программным обеспечением на базе машинного обучения для прогнозирования результатов для пациентов. Этот проект был начат с целью прогнозирования результатов для пациентов с почечно-клеточной карциномой с использованием регулярно собираемых статистических данных в таких источниках, как Шотландский регистр рака. С учетом этих дополнительных переменных точность диагнозов сравнительно возросла. Просто своевременно делясь симптомами по мере их появления, помогая врачам лучше персонализировать лечение, цифровые инструменты, такие как эти, смогли продлить жизнь пациентов на срок до пяти месяцев.
1 Циркулирующая свободная ДНК (cfDNA) - это деградированные фрагменты ДНК, высвобождающиеся в плазму крови.
2 Аферез - это физический метод получения отдельных компонентов крови или костного мозга, для чего исходный материал извлекается из организма и помещается в центрифугу для разделения компонент. Метод основан на различии размеров, скорости осаждения на фильтрах и других отличиях при центрифугировании.
По материалам Healthcare IT News, MedTech News, Asia-Pacific Journal of Oncology Nursing, Medgadget.com